|
Bệnh Melioidosis hay Withmore do vi khuẩn Burkholderia pseudomallei nguy hiểm ở người hiện nay
Bệnh Melioidosis (Withmore) là bệnh truyền nhiễm do trực khuẩn Gram âm Burkholderia pseudomallei được tìm thấy trong môi trường đất và nướclà một vấn đề y tế công cộng quan trọng tại các khu vực lưu hành bệnh, đặc biệt là tại Việt Nam và miền Bắc Australia. Bệnh tồn tại ở thể cấp tính và mãn tính bao gồm các biểu hiệu triệu chứng đau lưng, đau trong xương, khớp, ho nặng, nhiễm trùng da, hạch ở phổi và viêm phổi. Một số đặc điểm dịch tễ học Bản đồ toàn cầu cho thấy sự phân bố của melioidosis 1910-2014. Melioidosis là loài đặc hữu ở các vùng Đông Nam Á (bao gồm Thái Lan, Lào, Singapore, Brunei, Malaysia, Miến Điện và Việt Nam, Trung Quốc, Đài Loan và miền bắc Australia. Nhiều trường hợp cũng đã được mô tả ở Hồng Kông và Brunei, Ấn Độ và vài trường hợp lẻ tẻ ở Trung và Nam Mỹ, Trung Đông, Thái Bình Dương và một số nước châu Phi. Mặc dù chỉ có một trường hợp Melioidosis đã từng được báo cáo ở Bangladesh, ít nhất năm trường hợp đã du nhập vào Anh từ quốc gia đó. Báo cáo tin tức gần đây cho thấy B. pseudomallei đã được phân lập từ đất ở Bangladesh, nhưng điều này vẫn chưa được khoa học chứng minh. Điều này cho thấy melioidosis lưu hành tại Bangladesh và vẫn tồn tại vấn đề yếu kém trong chẩn đoán và báo cáo. Nhiều khả năng là do thiếu các cơ sở phòng thí nghiệm đầy đủ ở các khu vực nông thôn bị ảnh hưởng. Một tỷ lệ phân lập cao (tỷ lệ phần trăm của các mẫu đất dương tính với vi khuẩn gây bệnh) đã được tìm thấy ở Đông Saravan thuộc khu vực nông thôn tại Lào, khá xa sông Mekong,các nhà điều tra cho rằng đây là khu vực có nồng độ trung bình cao nhất trên thế giới (khoảng 464 (25-10,850 CFU/g đất). Một mô hình thống kê năm 2016 chỉ ra rằng tỷ lệ sẽ là 165.000 trường hợp mỗi năm (khoảng tin cậy 95%, 68.000 - 412.000), trong số đó có 138.000 ca xảy ra tại Đông và Nam Á và Thái Bình Dương. Khoảng một nửa trong những trường hợp mắc sẽ chết. Đông Bắc Thái Lan được ghi nhận có tỷ lệ mắc melioidosis cao nhất trên thế giới (tỷ lệ trung bình là 12,7 trường hợp/100.000 người mỗi năm). Ở Đông Bắc Thái Lan, 80% trẻ em dương tính với kháng thể chống lại B. pseudomallei trước 4 tuổi; con số này thấp hơn ở các bộ phận khác trên thế giới. Melioidosis là bệnh được ghi nhận xuất hiện ở động vật, kể cả mèo, dê, cừu, và ngựa. Gia súc, trâu nước, và cá sấu được cho là có khản năng kháng Melioidosis mặc dù chúng tiếp xúc liên tục với bùn. Một ổ dịch xảy ra tại vườn thú Paris vào những năm 1970 ("L'Affaire du jardin des plantes") được cho là có nguồn gốc từ một con gấu trúc được nhập cảnh về nước này. B. pseudomallei thường được tìm thấy trong đất và nước bề mặt; do đó, bệnh nhân mắc melioidosis hầu như không thay đổi đều có tiền sử tiếp xúc với đất hoặc nước bề mặt, cho thấy rằng, phần lớn các bệnh nhân người có tiếp xúc với đất không bị nhiễm thì không ảnh hưởng đến sức khỏe. Thậm chí trong cùng một khu vực, sự phân bố của B. pseudomallei trong đất có thể rất rời rạc, việc cạnh tranh với các loài Burkholderia khác được đề xuất có thể là một nguyên nhân. Ô nhiễm nguồn nước ngầm được cho là có liên quan đến một vụ dịch bùng phát ở miền bắc Australia. Thời tiết khắc nghiệt như lũ lụt, sóng thần và bão cũng liên quan đến bùng phát dịch. 
H1
Dựa trên phương pháp giải trình tự toàn bộ bộ gen, con người có thể đóng một vai trò trong việc di chuyển B. pseudomallei từ nơi này đến nơi khác. Các yếu tố nguy cơ quan trọng nhất đối với sự phát triển Melioidosis là đái tháo đường, tiếp theo là sử dụng rượu độc hại, những người mắc bệnh thận mãn tính và bệnh phổi mãn tính. Một số yếu tố nguy cơ khác bao gồm thiếu máu, bệnh liên quan đến nghề nghiệp (nông dân trồng lúa gạo) và xơ hóa u nang. Phương thức lây nhiễm được cho là thông qua vết nứt trên da, hoặc thông qua việc hít phải các tế bào B. pseudomallei bị khí dung. Lây truyền từ người sang người lan truyền đã được mô tả, nhưng hiếm khi xảy ra. Bệnh nhân hiễm HIV không dẫn đến mắc Melioidosis. Bệnh này rõ ràng có liên quan đến sự tăng lên của lượng mưa, với số lượng (và mức độ nghiêm trọng) của các trường hợp tăng sau khi mưa tăng lên. 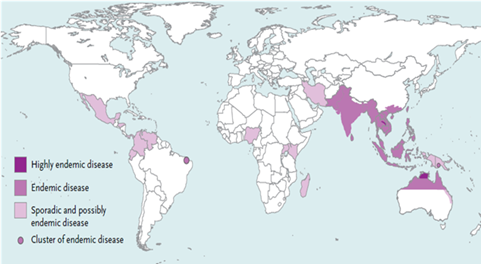
Hình 1: Bản đồ phân bố bệnh Melioidosis trên thế giới
Các khu vực có tỷ lệ Melioidosis lưu hành cao, các khu vực có bệnh lưu hành, hoặc lưu hành không thường xuyên, được biểu thị dựa trên những thông tin hiện tại thông qua một số bằng chứng hạn chế và có thể thay đổi theo thời gian. Lịch sử bệnh Melioidosis Đầu tiên, nhà nghiên cứu bệnh học Alfred Whitmore và trợ lý Krishnaswami báo cáo bệnh này ở người ăn xin, người nghiện morphine khi khám nghiệm tử thi ở Rangoon, ngày nay là Myanmar, trong một báo cáo được công bố vào năm 1912. Họ phân biệt nó với bệnh loét mũi truyền nhiễm, một căn bệnh mà cả con người và động vật có những biểu hiện tương tự như trong bài đã trình bày, nhưng nguyên nhân gây ra bởi một loại vi sinh vật khác nhau. B. pseudomallei, còn được gọi là trực khuẩn Whitmore, đã được xác định năm 1917 tại Kuala Lumpur. Arthur Conan Doyle có thể đã đọc báo cáo năm 1912 trước khi viết một câu chuyện ngắn mà liên quan đến các bệnh nhiệt đới hư cấu "sốt tapanuli" trong một cuộc phiêu lưu Sherlock Holmes. B. pseudomallei trước đây được phân loại thuộc giống Pseudomonas và cho đến năm 1992, nó được gọi là Pseudomonas pseudomallei. Trên cây phân loài, nó liên quan chặt chẽ với Burkholderia mallei, gây bệnh loét mũi truyền nhiễm, một bệnh nhiễm trùng chủ yếu ở ngựa, lừa và la. Tên Melioidosis có nguồn gốc từ tiếng Hy Lạp Melis (μηλις) có nghĩa là "sự đau đớn của con lừa" với các hậu tố -oid có nghĩa là "tương tự" và -osis nghĩa là "tình trạng hay bệnh", nghĩa là tình trạng tương tự như bệnh loét mũi truyền nhiễm ở ngựa. Thuật ngữ đồng nghĩa Pseudoglanders; Bệnh Whitmore (theo tên Captain Alfred Whitmore, người đầu tiên mô tả bệnh này); Bệnh của người làm vườn ở Nightcliff (Nightcliff là một vùng ngoại ô của Darwin, Australia,nơi melioidosis là loài đặc hữu); Bệnh Paddy-field; Bệnh nhiễm trùng huyết ở người nghiện tiêm morphine. Đặc tính di truyền và sinh học miễn dịch Phân loại B. pseudomallei thuộc giống burkholderia, gồm có hơn 40 loài. Một số loài gây bệnh khác gồmB. mallei - tác nhân gây bệnh sưng hạch ở ngựa và các loài thú có móng khác và có độc tính cao đối với con người và B. cenocepacia - một tác nhân gây nhiễm khuẩn cơ hội quan trọng ở các bệnh nhân mắc chứng xơ hóa nang (cystic fibrosis). Giống này cũng gồm B. thailandensis, một tác nhân cùng có mặt vớiB. pseudomallei trong đất ở một số quốc gia như Thái lan, Úc và B. oklahomensis, tác nhân được tìm thấy ở miền Trung - Tây Hoa Kỳ; hai loài hiếm này đều gây bệnh và có độc lực thấphơn nhiều so với B. pseudomallei ở chuột hamsters và chuột nhắt. Bộ gen có tính biến thiên và tiến hóa cao Bộ gene B. pseudomallei gồm hai cặp chromosomes lần lượt có độ dài 4,07 và 3,17 megabase, cho đến nay nó là một trong số những bộ gene di truyền của vi khuẩn phức tạp nhất đã được giải mã. B. pseudomallei có chung với các thành viên khác của giống burkholderia một tập hợp gồm 2.590 genes và có khả năng biến đổi cao. Có 86% bộ gene di truyền B. pseudomallei K96243 dạng tiền type là phổ biến trong tất cả các chủng và tương ứng với vùng gen bảo tồn (core genome), có 14% thay đổi hiện diện trong tất cả các chủng phân lập. Vùng gen biến đổi bao gồm nhiều vùng genomic island (thuật ngữ thường dùng trong Vi sinh, đặc biệt là vi khuẩn, nơi có chứa các gen mã hóa chức năng kháng kháng sinh của vi khuẩn) chứa DNA thu được từ các vi khuẩn khác. Vùng genomic island dường như có liên quan đến tính chất gây độc và khả năng nhiễm khuẩn, mặc dầu những tính chất riêng liên quan đến dấu hiệu lâm sàng vấn chưa được làm rõ. Việc xác định kiểu gene của khuẩn lạcB. pseudomallei từ một số vị trí mô ở 4 bệnh nhân mắc melioidosis cấp tính đã cho thấy tính đa dạng di truyền so với một bệnh nhân duy nhất, thể hiện khả năng của vi khuẩn có thể tiến hóa nhanh bên trong cơ thể vật chủ. Các yếu tố độc tính Nhiều yếu tố gây độc tiềm năng của B. pseudomallei đã từng được mô tả, nhưng tính chất quan trọng của mỗi yếu tố gây bệnh đối với cơ thể người vẫn chưa được nghiên cứu đầy đủ. Hệ thống quorum - sensing (quá trình liên lạc giữa các tế bào vi khuẩn với nhau, mô tả sự điều chỉnh về biểu hiện gen dựa theo mật độ quần thể) ảnh hưởng đến yếu tố hành vi của toàn bộ quần thể vi khuẩn qua chất tiết ngoại bào của N-acyl homoserine lactones. B. pseudomallei chứa 3 nhóm (cluster) gene của hệ thống tiết type III (TTSS) mà mã hóa cáccầu với màng tế bào (membrane-spanning syringes) để vận chuyển các phân tử phản ứng kích thích của vi khuẩn vào bào tương tế bào vật chủ; hệ thống TTSS3 hay hệ thống Inv/Mxi-Spa, đóng vai trò quyết định khả năng tồn tại nội bào của trực khuẩn bằng cách tác động đến các quá trình chuyển hóa của vật chủ. Các đột biến TTSS3 gây bất thường lên khả năng sống sót nội bào của B. pseudomallei và ngăn cản sự lẫn tránh của vi khuẩn khỏi các không bào (endocytic vacuoles). Bộ mã di truyền của B. pseudomallei mã hóa 6 hệ thống tiết type VI, quyết định độc tính của vi khuẩn, sự sống sót nội bào và sự cạnh tranh với các vi khuẩn khác. Vỏ bao ngoài polysaccharide, lipopolysaccharide, và hai O-polysaccharides bề mặt khác (O-PS; types III O-PS và IV O-PS) là những yếu tố độc tính được phát hiện thêm. Roi (flagella) có thể có tính chất quan trọng đối với sự di chuyển và xâm nhập tế bào vật chủ củaB. pseudomallei, mặc dầu sự quan trọng của nó trong khả năng tạo độc tính trong bệnh sinh ở người vẫn đang tranh cãi. Yếu tố 1 gây tử vong của Burkholderia tương tự với yếu tố 1 gây độc hoại tử tế bào của Escherichia coli và cản trở giai đoạn dịch mã ban đầu, dẫn đến cho sự biến đổi actin của bộ khung tế bào và cuối cùng gây chết tế bào. 
H3
Sức đề kháng của vật chủ chống lại vi khuẩnB. pseudomallei Hoạt động nội bào B. pseudomallei có thể xâm nhập, sống, và nhân lên ở cả tế bào thực bào lẫn tế bào không thực bào, và tập tính hoạt động nội bào của nó được xem là cực kỳ quan trọng đối với tính chất sinh bệnh. Sau khi xâm nhập nội bào, vi khuẩn này có thể lẫn tránh không bào và nhân lên bên trong tế bào chất của tế bào vật chủ. Sau đóB. pseudomallei có khả năng gây cảm ứng các đuôi actin được tổng hợp từ những sợi actin bị phân cực và cho phép vi khuẩn chuyển động bên trong tế bào, với sự hình thành kế tiếp của các gai nhú ra màng tế bào và trực tiếp lây nhiễm vi khuẩn từ tế bào này đến tế bào khác. B. pseudomallei còn có khả năng hình thành nên các tế bào khổng lồ. 
H4
Sự nhận diện B. Pseudomallei và đáp ứng miễn dịch Các thụ thể nhận diện, đặc biệt là thụ thể Toll-like (TLRs) và thụ thể giống (NOD)–like (nucleotide-binding oligomerization domain) (NLRs) có thể phát hiện trước tiên sự xâm nhập của tác nhân gây bệnh vào tế bào vật chủ, gây nên các đáp ứng miễn dịch bẩm sinh và hình thành nên sự liên kết đặc biệt quan trọng giữa miễn dịch bẩm sinh và miễn dịch đáp ứng. Các thụ thể của sự nhận diện phát hiện các cấu trúc bảo tồn trong tác nhân gây bệnh được gọi là “các cấu trúc phân tử liên quan đến tác nhân gây bệnh” (pathogen associated molecular patterns - PAMPs). Vi khuẩn B. pseudomallei biểu hiện rất nhiều các PAMPs khác nhau, gồm lipopolysaccharide, peptidoglycan, flagella, TTSS, và DNA, được nhận diện bởi nhiều thụ thể TLRs khác nhau, và liên quan đến các phân tử như CD14 và MD2, có khả năng điều hòa ở bệnh nhân mắc melioidosis. Những biến đổi gene vùng TLR4 ở người có liên quan đến tính nhạy cảm với melioidosis. Liệu rằng thành phần lipopolysaccharide của các tín hiệu của B. pseudomallei được nhận diện bởi TLR2, giống như lipopolysaccharide củaLegionella pneumophila và Leptospira interrogans, hoặc nhận diện bởi TLR4 - được xem là thụ thể củalipopolysaccharide hay không, vẫn còn là chủ đề nghiên cứu cần được quan tâm. 
H5
Điều thú vị là chuột thiếu CD14 và TLR2 được gây cảm nhiễm melioidosis thực nghiệm cải thiện đát để sự bảo vệ của vật chủ, phản ánh khả năng sống sót mạnh mẽ, trái lại chuột thiếu TLR4 không thể phân biệt với chuột type hoang dã về sự phát triển nhanh chóng và sống sót của vi khuẩn. B. pseudomallei cũng có thể hoạt hóa túi viêm trong đại thực bào (cytosolic inflammasome), một phức hợp protein, lớn được hình thành bởi NLRs NLRC4 và NLRP3, sự đồng nhất của chúng dẫn đến sự hoạt hóa của caspase 1 và điều khiển sự trưởng thành của các cytokines tiền viêm, interleukin-1β và interleukin-18. Interleukin-18 đóng một vai trò bảo vệ suốt quá trình mắc bệnh melioidosis thông qua sự tiết ra interferon-γ, một cytokine quan trọng góp phần hình thành sự bảo vệ chống lại melioidosis. Thông qua so sánh, interleukin-1β có thể đóng một vai trò tiêu diệt bằng cách kêu gọi số lượng lớn bạch cầu đa nhân trung tính, gâythương tổn mô và bằng cách ức chế sự hoạt hóa sản xuất interferon-γ. B. pseudomallei hoạt hóa caspase 1 thông qua NLRC4, một thụ thể đối với thành phần BsaK của TTSS3, dẫn đến các đại thực bào chết một cách nhanh chóng, được gọi là quá trình pyroptosis (chết tế bào lệ thuộc caspase hạn chế sự tăng trưởng vi khuẩn nội bào) được dùng như là một cơ chế đề kháng vật của chủ nhằm hạn chế sự tăng trưởng của vi khuẩn nội bào. Đáp ứng miễn dịch được bắt đầu bởi các thụ thể nhận diện, dẫn đến sự tập trung các bạch cầu đa nhân trung tính, đại thực bào, và các tế bào lympho đến các vị trí nhiễm khuẩn. Mặc dầu sự tập trung các bạch cầu đa nhân trung tính có thể gây bất lợi, các bạch cầu được hoạt hóa đóng vai trò quan trọng trong việc ngăn chặn vi sinh vật trong giai đoạn sớm. Các nghiên cứu chuột khiếm khuyết tế bào đã cho thấy rằng các tế bào T, đặc biệt là các tế bào T-CD4+, góp phần quan trọng trong cả miễn dịch bẩm sinh lẫn miễn dịch đáp ứng trong việc chống lại khả năng nhiễm B. pseudomallei, mặc dầu không có sự liên quan nào giữa nhiễm HIV và nguy cơ mắc bệnh Melioidosis. Các cytokines tiền viêm, TNF - α và IL - 6, cả hai cytokine này được điều hòa trong quá trình melioidosis, hoạt hóa quá trình đông máu trong thể nhiễm melioidosis nặng. Tất cả 3 con đường chính đều liên quan với nhau, cùng với hỗ trợ đồng thời cơ chế tiền đông và sự bất thường của cơ chế kháng đông và các cơ chế tiêu fibrin. Hệ thống bổ thể, chịu trách nhiệm đối với việc duy trì ổn định nội môi của tế bào vật chủ và quá trình opsonin hóa và việc loại trừ vi khuẩn, được hoạt hóa nhanh chóng và sử dụng suốt quá trình nhiễm B. pseudomallei. Sinh bệnh học miễn dịch của bệnh Melioidosis: B. pseudomallei có thể xâm nhập vào tế bào đại thực bào, sau đó sống sót và nhân lên trong suốt thời gian dài của quá trình xâm nhiễm. Mặc dù một số vi khuẩn bị phá hủy sau quá trình thực bào, một tỷ lệ các sinh vật có khả năng thoát khỏi không bào có nhiệm vụ thực bào nội mô, thoát ra vùng ngoại bào và xâm nhập vào tế bào khác thông qua sự nhú ra của các sợi actin trên màng tế bào. Thụ thể giống Toll-like (TLRs) biểu hiện trên tế bào vật chủ trước tiên sẽ phát hiện sựxâm nhập của B. pseudomallei, làm cho yếu tố nhân κB (nuclear factor-κB - NF-κB) hoạt hóa quá trình đáp ứng miễn dịch thông qua việc giải phóng các cytokine tiền viêm. 
H6
Đáp ứng của TLR được điều hòa một cách chặt chẽ: khởi động thụ thể được biểu hiện trên các tế bào 1 dòng tủy (triggering receptor expressed on myeloid cells 1: TREM-1) khuếch đại các tín hiệu TLR, và phân tử giống như interleukin 1 receptor–associated kinase (IRAK), IRAK-M được kết hợp nhằm làm giảm đáp ứng miễn dịch suốt quá trình mắc melioidosis. Các thụ thể túi viêm nội bào (intracellular inflammasome receptors), đáng chú ý nhất, các thụ thể giống như nucleotide-binding oligomerization domain (NOD) (NLRs) NLRC4 và NLRP3, phát hiện các yếu tố gây độc của vi khuẩn và các tín hiệu nội sinh nguy hiểm, dẫn đến việc giải phóng interleukin-1β và interleukin-18 qua trung gian caspase 1, bên cạnh quá trình pyroptosis (chết tế bào lệ thuộc caspase làm hạn chế sự tăng trưởng vi khuẩn nội bào). Hơn nữa Interleukin-18 còn kích thích sự sản xuất interferon-γ có tính chất bảo vệ. Bạch cầu đa nhân trung tính được tập trung tới vị trí nhiễm khuẩn, và các bổ thể và capcase đông máu được hoạt hóa. Suốt quá trình nhiễm khuẩn, đáp ứng miễn dịch mắc phải dẫn đến sự tập hợp của các tế bào T góp phần sản xuất interferon-γ, làm tăng đáp ứng miễn dịch trung gian tế bào và sản xuất kháng thể của các tế bào B. Hầu hết dữ liệu trong mô hình này xuất phát từ những nghiên cứu in vitro và mô hình động vật thực nghiệm nhiễm Melioidosis. Quá trình chết tế bào theo chương trình liên quan đến protein speck-like gồm vùng tập hợp caspase (ASC) được dùng như một phân tử đáp ứng NLR, trái lại yếu tố biệt hóa tế bào tủy 88 (myeloid differentiation factor 88 - MyD88) được dùng như một phân tử đáp ứng TLR trung tâm. Dấu chứng và triệu chứngbệnh Thể Melioidosis cấp tính Trong một nhóm nhỏ các bệnh nhân có thời gian ủ bệnh đáng lưu ý, thời gian ủ bệnh Melioidosis cấp tính trung bình là 9 ngày (từ 1-21 ngày). Bệnh nhân mắc Melioidosis tiềm ẩn có thể không có triệu chứng bệnh trong nhiều thập kỷ; thời gian dài nhất giữa việc tiếp xúc và biểu hiện lâm sàng là 62 năm. 
H7
Một số triệu chứng lâm sàng khi nhiễm B. pseudomallei: Melioidosis có thể có một loạt các biểu hiện lâm sàng đa dạng, và mức độ nặng thay đổi từ một bệnh cảnh nhiễm khuẩn toàn thân bùng phát cấp tính đến một tình trạng nhiễm khuẩn mãn tính. Biểu thị các đường nhiễm (các ô xanh: xâm nhập qua da, xâm nhập do hít vào, và nuốt phải), các dạng lâm sàng (các ô đỏ: nhiễm không triệu chứng, nhiễm khuẩn máu, hoặc tái phản ứng của ổ nhiễm khu trú), và các biểu hiện đa dạng của bệnh (phần chữ không ô). Phần A biểu thị Melioidosis da ở một vật chủ khỏe mạnh. Phần B biểu thị các áp xe ở phổi trên X quang lồng ngực của một bệnh nhân viêm phổi do Melioidosis cấp tính, Phần C biểu thị hình ảnh phổi tương ứng với quét CT. Phần D biểu thị các biểu hiện da ở một trường hợp tử vong do Melioidosis lan tỏa. Phần E biểu thị áp xe lách trên quét CT bụng. Phần F biểu thị mủ được hút ở một bệnh nhân áp xe tiền liệt tuyến và quanh tuyến tiền liệt, và phần G biểu thị các áp xe trên một quét CT của một bệnh nhân. Thời gian ủ bệnh kéo dài đã được ghi nhận trong quân đội Mỹ tham gia chiến tranh Việt Nam và được gọi là "quả bom hẹn giờ Việt Nam". Mức độ nghiêm trọng phổ biến đối với thể mãn tính, triệu chứng có thể kéo dài nhiều tháng, nhưng khi bệnh bộc phát, đặc biệt có liên quan đến trường hợp đuối nước, với các triệu chứng nghiêm trọng trong vài giờ. 
H8
Bệnh nhân mắc Melioidosis thể hoạt động thường có biểu hiện sốt. Đau hoặc các triệu chứng khác có thể là một gợi ý lâm sàng, được tìm thấy ở khoảng 75% bệnh nhân. Những triệu chứng bao gồm ho hoặc đau ngực gợi ý cho viêm phổi, đau xương hoặc đau khớp gợi ý cho viêm tủy xương hoặc viêm khớp, hoặc viêm mô tế bào. Nhiễm trùng ổ bụng (bao gồm cả gan và / hoặc áp xe lách, hoặc áp xe tuyến tiền liệt) thường không có biểu hiện đau các vùng trung tâm và hình ảnh chụp CT-scanner hay khảo sát siêu âm các cơ quan này nên được thực hiện thường xuyên. Bệnh được phát hiện tại nhiều cơ quan khác nhau: áp xe tuyến mang tai đặc trưng xảy ra ở trẻ em Thái Lan, nhưng bệnh này chỉ mới được mô tả lần ở Úc. Ngược lại, áp xe tuyến tiền liệt được tìm thấy trong 20% nam giới Úc, nhưng hiếm khi được mô tả ở những các quốc gia khác. Hội chứng viêm não đã được ghi nhận ở miền bắc Australia. 
H9
Trong một loạt 214 bệnh nhân, có 27,6% có ổ áp xe ở gan hoặc lách (CI: 95%, 22-33,9%). Ổ áp xe do B. pseudomallei trên ảnh chụp CT-scanner có thể có đặc điểm như "tổ ong" hoặc cấu trúc như "bơ Thụy Sĩ" dạng giảm âm, đa chiều và đa ổ. Trong số 25% bệnh nhân, không có ca nhiễm trùng nào được ghi nhận, chẩn đoán thường được thực hiện bằng phương pháp nuôi cấy máu hoặc nuôi cấy từ que phết mẫu bệnh phẩm ở họng. Melioidosis được biết có tác động đến bất kỳ cơ quan nào trong cơ thể ngoại trừ mạch máu (nội mô). Mặc dù, viêm màng thứ phát được mô tả gây nên áp xe não, viêm màng não tiên phát lại không được đề cập đến. Biểu hiện lâm sàng ít gặp hơn là nhiễm trùng máu nội mạch, áp xe hạch bạch huyết (1,2-2,2%), viêm màng bao tim và viêm cơ tim, áp xe tuyến giáp và áp-xe vùng bìu bộ phận sinh dục nam và nhiễm trùng ở mắt. Bệnh nhân nhiễm Melioidosis thường có các yếu tố nguy cơ mắc bệnh như tiểu đường, bệnh thiếu máu, ngộ độc rượu, hoặc bệnh thận và thường xuyên có tiền sử phơi nhiễm bệnh nghề nghiệp khi tiếp xúc với bùn hoặc nước bề mặt được đào xới. Tuy nhiên, bệnh nhân khỏe mạnh khác, kể cả trẻ em, cũng có thể mắc Melioidosis. 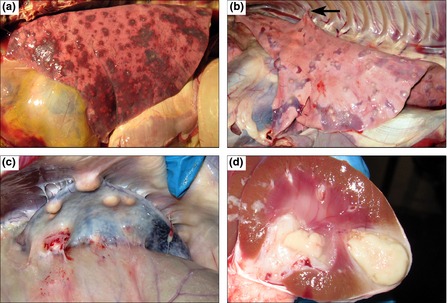
H10
Thể Melioidosis mãn tính Melioidosis mãn tính thường được xác định bởi thời gian của các triệu chứng kéo dài hơn hai tháng và xảy ra ở khoảng 10% bệnh nhân. Biểu hiện lâm sàng của Melioidosis mãn tính là hay thay đổi và bao gồm các biểu hiện như nhiễm trùng da mãn tính, hạch phổi mãn tính, viêm phổi. Đặc biệt, Melioidosis mãn tính khá giống với lao, và đôi khi được gọi là " bệnh lao Việt Nam". Chẩn đoán lâm sàng và chẩn đoán phòng thí nghiệm Phân lập B. pseudomallei từ chất dịch cơ thể của bệnh nhân vẫn là "tiêu chuẩn vàng" trong chẩn đoán và đòi hỏi việc sử dụng các môi trường chọn lọc cho các mẫu xét nghiệm không vô trùng. Nhuộm Gram và nhuộm mô bệnh học đều không đặc hiệu với loại vi sinh vật này. Một số kỹ thuật đã được sử dụng nhằm giảm thời gian cần thiết để chẩn đoán chính xác, bao gồm phát hiện kháng nguyên trên mẫu xét nghiệm hoặc dịch nổi nuôi cấy, phát hiện kháng thể, kỹ thuật sinh học phân tử và kỹ thuật nuôi cấy nhanh. Mặc dù các xét nghiệm nhanh đã được phát triển, rất ít trong số đó được thử nghiệm rộng rãi, chỉ có IHA, ngưng kết Latex, và miễn dịch huỳnh quang hiện đang được sử dụng trên lâm sàng. Phương pháp nuôi cấy Môi trường chọn lọc từ lâu đã được sử dụng để phân lập B. pseudomallei từ dịch không vô trùng và mẫu bệnh trong môi trường, sử dụng vi sinh vật có khả năng kháng kháng sinh phổ rộng. Ashdown thử nghiệm trên môi trường mang tên ông, có chứa thạch tryptase đậu nành với glycerol, tím tinh thể, màu đỏ trung tính, và gentamicin (4 mg/L), trên 8.000 mẫu lâm sàng ở Townsville, Australia, năm 1979. Vi khuẩn B. pseudomallei đã được phân lập với 8 mẫu, với Klebsiella spp. (n = 73), P. aeruginosa (n=57), Enterococcus faecalis (n = 23), B. cepacia (n = 17) và Serratia marcescens (n = 14) là các nhiễm khuẩn phổ biến nhất. Môi trường Ashdown có thay đổi thành phần, với Colistin, hiện nay đã trở nên thông dụng. Số lương vi khuẩn nuôi cấy từ các mẫu bệnh phẩm từ cổ họng, trực tràng, dịch ngoáy vết thương hở có thể tăng lên bằng cách sử dụng canh thang có tính chọn lọc. Việc sử dụng môi trường chọn lọc B. pseudomallei được mô tả gần đây (BPSA) và môi trường chọn lọc B.cepacia được sử dụng rộng rãi hiện đang được đánh giá ở Thái Lan. 
H11
Thời gian cho kết quả cấy máu dương tính, phản ánh mật độ nhiễm khuẩn, tương quan với tỷ lệ tử vong; 73,7% bệnh nhân tử vong nếu kết quả cấy máu dương tính trong vòng 24 giờ, so với 40,9% những bệnh nhânđược phát hiện dương tính > 24 giờ. Trong nghiên cứu này, bằng cách sử dụng hệ thống BacT /Alert tự động, 62% mẫu nuôi cấy dương tính được phát hiện trong 24 giờ đầu tiên và hơn 90% đã được phát hiện trong vòng 48 giờ. Phương pháp cấy máu thay thế có thể giảm thời gian để thu được kết quả dương tính nhưng giảm độ nhạy. So với cấy máu truyền thống trên môi trường canh thang (trung bình thời gian để thu được kết quả dương tính là 61,8 h; n = 42). Nuôi cấy từ tủy xương có độ nhạy giống như cấy máu. Phát hiện kháng nguyên Mặc dù nhiều phương pháp khác nhau phát hiện kháng nguyên đã được nghiên cứu, vẫn chưa có phương pháp nào được áp dụng rộng rãi. Các xét nghiệm xác định kháng nguyên đã được phát triển để sử dụng trên các mẫu bệnh phẩm trực tiếp hoặc dịch nổi của cấy máu. Trong số này, phương pháp ngưng kết latex để xác định và miễn dịch huỳnh quang (immunofluoresence) trực tiếp từ mẫu bệnh phẩm trực tiếp (như đờm, nước tiểu, hoặc mủ) đã được sử dụng trong các phòng thí nghiệm nghiên cứu ở Thái Lan. 
H12
Các xét nghiệm kháng nguyên tìm độc tố exotoxin và tế bào thành phần đã cho thấy độ nhạy và độ đặc hiệu hợp lý trong các nghiên cứu, nhưng hầu hết chưa được đem ra thử nghiệm. Chúng bao gồm hai xét nghiệm ELISA, cho exotoxin trong dịch nổi của nuôi cấy, một protein tiết có trọng lượng phân tử 40 kDa và các kháng thể đơn dòng cho các thành phần vách tế bào, bao gồm LPS, một protein có trọng lượng 30kDa, và một exopolysaccharide. Một hệ thống kháng nguyên tiết niệu huỳnh quang đã được phát triển; trong các thử nghiệm ban đầu, độ nhạy 81% và độ đặc hiệu là 96% được xác định, nhưng một đánh giá tiếp theo đã cho kết quả kém hơn. Một test xét nghiệm duy nhất được sử dụng rộng rãi ở Thái Lan hiện nay là một thử nghiệm ngưng kết latex kháng thể đơn dòng đối với một protein có trọng lượng phân tử 200 kDa, phương pháp này được đánh giá tại 12 trung tâm ở Thái Lan. Kết quả chứng minh là ngưng kết dịch cấy máu dương tínhvới B. pseudomallei , bao gồm chủng có LPS không điển hình, với độ nhạy 95%. Xét nghiệm này cũng cho độ đặc hiệu cao và không ngưng kết ara+ B. thailandensis với độ đặc hiệu là 99,7%. Miễn dịch huỳnh quang từ mẫu trực tiếp (gồm nước bọt, nước tiểu, và mủ) là phương pháphứa hẹn nhất để giảm thời gian để chẩn đoán tại các vùng có bệnh lưu hành. Kết quả là có thể đạt được trong vòng một giờ, nhưng chỉ khi có sẵn các điểm kính hiển vi chuyên sâu. Thuốc thử dựa trên kháng thể đối với lipopolysaccharide và các mảnh protein của B. pseudomallei nhưng không có sẵn. Miễn dịch huỳnh quang (Immunofluoresence), cũng như ngưng kết hạt latex, cũng hữu ích trong việc xác định B. pseudomallei từ môi trường nuôi cấy cũng như trong việc phân biệt B. pseudomallei và B. thailandensis. 
H13
Phát hiện kháng thể. IHA vẫn là thử nghiệm được sử dụng rộng rãi nhất mặc dù độ nhạy và độ đặc hiệu kém. Nó được mô tả đầu tiên năm 1965 và đã được sử dụng rộng rãi trong điều tra huyết thanh học. Một phương pháp cũ hơn là thử nghiệm cố định bổ thể. Việc sử dụng của IHA là có vấn đề khó giải quyết tại khu vực lưu hành, đặc biệt là ở Thái Lan, nơi có tỷ lệ huyết thanh dương tính nền có thể lên đến 30-47% trong các quần thể khác nhau, có lẽ là do phơi nhiễm /tiếp xúc với cận lâm sàng với B. thailandensis hoặc B. pseudomallei sớm trong cuộc đời. Huyết thanh dương tính nền dường như là ít phổ biến ở Australia, ngoại trừ những người nhập cư từ Đông Nam Á; hiệu giá kháng thể thấp ở Úc phản ánh điều này (01:40, so với 1:160 trong Thái Lan). Mặc dù, các kháng thể IgM cần đặc hiệu hơn. Các test phát hiện kháng thể IgM không phản ánh được điều này. Các nghiên cứu về hiệu quả lâm sàng của IHA rất khó để so sánh, các ngưỡng khác nhau được sử dụng để giải thích (giữa 1:10 và 1: 160 trong các nghiên cứu khác nhau) và các chủng sử dụng để xây dựng các kháng nguyên toàn bộ tế bào không được chuẩn hóa. Tuy nhiên, rõ ràng là sự nhạy cảm của IHA được giới hạn ở những bệnh nhân mắc các bệnh nhiễm khuẩn cấp tính. Hơn nữa, có một số không đồng nhất giữa các chủng trong LPS, một thành phần chính trong các kháng nguyên thô được sử dụng trong các IHA;kháng thể chống lại LPS không điển hình có thể không phản ứng chéo với các kháng nguyên IHA, tùy thuộc vào loài sinh vật nào được sử dụng để làm thuốc thử trong thử nghiệm IHA. Các xét nghiệm khác để phát hiện kháng thể cũng cho kết quả tương tự, và không có phương pháp nào hiệu quả hơn để thay thế IHA. Một xét nghiệm miễn dịch tạo màu (immunochromogenic) nhanh (PanBio Ltd, Brisbane, Queensland, Australia) cho IgM và IgG cho kết quả tốt trên một loạt 121 bệnh nhân. Tuy nhiên, độ nhạy cao (IgG, 100%; IgM, 93%) và độ đặc hiệu (cả hai xét nghiệm, 95%) được báo cáo như tiêu chuẩn vàng, so với IHA, và cho kết quả tốt hơn so với nuôi cấy. Kết quả tương tự đã được báo cáo từ các khu vực phía Bắc Territory, thể hiện một mối tương quan tốt với IHA. Nghiên cứu gần đây ở Thái Lan cho rằng thử nghiệm immunochromogenic đối với IgG (PanBio TNHH) cho độ nhạy vừa phải (79%), nhưng đặc hiệu hơn (90%) so với IHA và giá trị tiên đoán dương vẫn có giá trị sau này. Tuy nhiên, một nghiên cứu song song thực hiện ở Darwin đã chứng minh rằng sự biểu hiện IgG tương tự với IHA, trong khi IgM có độ đặc hiệu kém hơn so với nuôi cấy. Tuy nhiên, một bộ KIT xét nghiệm thương mại sử dụng các kháng nguyên chuẩn sẽ có ích cho các khu vực nơi mà các sinh vật không phải là loài đặc hữu, trong đó giá trị tiên đoán dương của một thử nghiệm huyết thanh cao hơn nhiều so với bình thường. 
H15
Phương pháp sinh học phân tử Nhiều xét nghiệm dựa trên phát hiện B. pseudomallei về góc độ phân tử của đã được mô tả, nhưng khá ít trong thực nghiệm. Cặp mồi cho vùng rRNA 23S, RNA 16S, và RNA nối 16S và 23S đã được đánh giá. Việc sử dụng các cặp mồi để phát hiện vùng của RNA 16S chứng minh độ nhạy 100% nhưng độ đặc hiệu thấp trong một nghiên cứu lâm sàng nhỏ. Nhiều nghiên cứu gần đây đang xem xét vai trò của một PCR đối với hệ thống tiết type III trong các mẫu lâm sàng và mẫu trong môi trường (D. Gal, dữ liệu chưa công bố), cũng như các cặp đặc hiệu với mRNA 16S. Trình tự mRNA 16S từ lâu đã được sử dụng cho việc xác định các loài vi khuẩn; Phương pháp này đã được sử dụng để vẽ cây phát sinh loài cũng như xác định lâm sàng của Burkholderia spp. Trình tự của gen groEL cũng có thể hữu ích nhưng có thể không đáng tin cậy để phân biệt B. mallei và B. pseudomallei. Chẩn đoán ca bệnh Chẩn đoán nhằm xác định bệnh được thực hiện bằng phương pháp nuôi cấy vi sinh vật từ bất kỳ các mẫu lâm sàng, bởi vì các vi sinh vật này không bao giờ thường trú ở người bình thường. Tiền sử tiếp xúc với đất có thể không gợi ý được điều gì, nhưng bệnh melioidosis có thể không hoạt động trong nhiều năm trước khi biểu hiện. Du khách cần chú ý về tiền sử đi vào vùng dịch tễ khi quay trở lại. Một số tác giả khuyên nên xem xét khả năng nhiễm Melioidosis ở mỗi bệnh nhân sốt có tiền sử đi du lịch đến và /hoặc tạm trú tại các vùng dịch tễ. Quá trình theo dõi đầy đủ (cấy máu, cấy đờm, cấy nước tiểu, ngoáy họng, và nuôi cấy dịch mủ đường hô hấp) phải được thực hiện trên tất cả các bệnh nhân nghi ngờ melioidosis (nuôi cấy trên môi trường thạch máu cũng như trên môi trường Ashdown’s). Một chẩn đoán xác định được thực hiện bằng cách nuôi cấy B. pseudomallei từ bất kỳ mẫu bệnh phẩm gì. Dịch ngoáy họng không có độ nhạy cao, nhưng độ đặc hiệu đạt 100%, nếu so sánh với cấy đờm. Độ nhạy của phương pháp nuôi cấy nước tiểu tăng lên nếu mẫu đã được ly tâm đem đi nuôi cấy, và bất kỳ vi khuẩn nào phát triển nên được báo cáo (không chỉ trong trường hợp tăng trưởng trên 104 vi khuẩn/ ml, thường được dùng là ngưỡng cắt cutoff level). Cấy tủy xương phát hiện dương tính ở những bệnh nhân có cấy máu âm tính với B. Pseudomallei hiếm khi xảy ra, thường không được khuyến khích. Một lỗi phổ biến là do các bác sĩ không quen làm việc với melioidosis , họ chỉ gửi một mẫu được thực hiện với một phương pháp (quy trình thường quy đối với hầu hết các nhiễm trùng khác) thay vì gửi một kết quả theo dõi đầy đủ. Môi trường Ashdown’s là môi trường chọn lọc có chứa gentamicin, có thể được yêu cầu trong nuôi cấy các mẫu không vô trùng. Môi trường nuôi cấy Burkholderia cepacia có thể là môi trường chọn lọc thay thế hữu ích tại các khu vực không có lưu hành, nếu không có sẵn môi trường Ashdown’s. Một loại môi trường mới khác có nguồn gốc từ Ashdown, được gọi là môi trường Francis, có thể giúp phân biệt giữa B. pseudomallei và B. cepacia và cũng có khả năng chẩn đoán sớm Melioidosis, nhưng vẫn chưa được xác nhận rộng rãi về mặt lâm sàng. Xét nghiệm huyết thanh học tìm Melioidosis (ngưng kết hồng cầu gián tiếp) có thể thực hiện, nhưng không được áp dụng đại trà ở hầu hết các nước. Độ chuẩn nền cao có thể làm giảm giá trị tiên đoán dương tính của xét nghiệm huyết thanh học tại các quốc gia có lưu hành bệnh. Xét nghiệm miễn dịch huỳnh quang và ngưng kết latext trực tiếp, dựa trên các kháng thể đơn dòng, được sử dụng rộng rãi ở Thái Lan, nhưng không được thực hiện ở các quốc gia khác. Phản ứng chéo với B. thailandensis hầu như xảy ra. Bộ kit ELISA thương mại chẩn đoán Melioidosis cho kết quả tốt, nhưng không có xét nghiệm ELISA nào được xác nhận như một công cụ chẩn đoán. Nhiều kit thương mại để xác định vi khuẩn có thể chẩn đoán nhầm B. pseudomallei hiện nay, việc chẩn đoán chỉ dựa trên hình ảnh là không thể thực biện được (X-quang và CT-scan), nhưng hình ảnh chụp thường xuyên được thực hiện để đánh giá mức độ đầy đủ của bệnh. Hình ảnh của bụng sử dụng máy quét CT hoặc siêu âm được khuyến khích thường xuyên, như ổ áp xe có thể không được rõ ràng trên lâm sàng và có thể cùng tồn tại với bệnh ở những vị trí khác trong cơ thể. Một số tác giả người Úc cho thấy hình ảnh của tuyến tiền liệt đặc biệt liên quan đến tỷ lệ lớn mắc áp xe tuyến tiền liệt ở những bệnh nhân miền bắc Australia. Hình ảnh chụp X-ray ngực cũng được theo dõi thường xuyên, với các điều tra khác theo chỉ định lâm sàng. Sự hiện diện của các ổ áp xe hình tổ ong trong gan được coi là đặc trưng, nhưng không phải là dấu hiệu chẩn đoán. Chẩn đoán phân biệt được đặt ra mở rộng vì bệnh Melioidosis có triệu chứng có thể giống nhiều bệnh nhiễm trùng và truyền nhiễm khác, kể cả bệnh lao. TÀI LIỆU THAM KHẢO 1.White NJ. Melioidosis. Lancet 2003; 361:1715-22. 2.Cheng AC, Currie BJ. Melioidosis: epidemiology, pathophysiology, and management. Clin Microbiol Rev 2005;18:383- 416. Erratum, Clin Microbiol Rev 2007; 20:533. 3.Stewart T, Engelthaler DM, Blaney DD, et al. Epidemiology and investigation of melioidosis, Southern Arizona. Emerg Infect Dis 2011;17:1286-8. 4.Deshazer D. Virulence of clinical and environmental isolates of Burkholderia oklahomensis and Burkholderia thailandensis in hamsters and mice. FEMS Microbiol Lett 2007;277:64-9. 5.Holden MT, Titball RW, Peacock SJ, et al. Genomic plasticity of the causative agent of melioidosis, Burkholderia pseudomallei. Proc Natl Acad Sci U S A 2004; 101:14240-5. 6.Nandi T, ong C, Singh AP, et al. A genomic survey of positive selection in Burkholderia pseudomallei provides insights into the evolution of accidental virulence. PLoS Pathog 2010;6(4):e1000845. 7.Wiersinga WJ, van der Poll T, White NJ, Day NP, Peacock SJ. Melioidosis: insights into the pathogenicity of Burkholderia pseudomallei. Nat Rev Microbiol 2006;4:272-82. 8.Tumapa S, Holden MT, Vesaratchavest M, et al. Burkholderia pseudomallei genome plasticity associated with genomic island variation. BMC Genomics 2008; 9:190. 9.Sim SH, Yu Y, Lin CH, et al. The core and accessory genomes of Burkholderia pseudomallei: implications for human melioidosis. PLoS Pathog 2008;4(10): e1000178. 10.Price EP, Hornstra HM, Limmathurotsakul D, et al. Within-host evolution of Burkholderia pseudomallei in four cases of acute melioidosis. PLoS Pathog 2010; 6(1):e1000725. 11.Gamage AM, Shui G, Wenk MR, Chua KL. N-Octanoylhomoserine lactone signalling mediated by the BpsI-BpsR quorum sensing system plays a major role in biofilm formation of Burkholderia pseudomallei. Microbiology 2011;157:1176-86. 12.Estes DM, Dow SW, Schweizer HP, Torres AG. Present and future therapeutic strategies for melioidosis and glanders. Expert Rev Anti Infect Ther 2010;8:325-38. 13.Stevens MP, Wood MW, Taylor LA, et al. An Inv/Mxi-Spa-like type III protein secretion system in Burkholderia pseudomallei modulates intracellular behaviour of the pathogen. Mol Microbiol 2002;46: 649-59. 14.Schwarz S, West TE, Boyer F, et al. Burkholderia type VI secretion systems have distinct roles in eukaryotic and bacterial cell interactions. PLoS Pathog 2010; 6(8):e1001068. 15.Burtnick MN, Brett PJ, Harding SV, et al. The cluster 1 type VI secretion system is a major virulence determinant in Burkholderia pseudomallei. Infect Immun 2011;79:1512-25. 16.Cruz-Migoni A, Hautbergue GM, Artymiuk PJ, et al. A Burkholderia pseudomallei toxin inhibits helicase activity of translation factor eIF4A. Science 2011; 334:821-4. 17.Allwood EM, Devenish RJ, Prescott M, Adler B, Boyce JD. Strategies for intracellular survival of Burkholderia pseudomallei. Front Microbiol 2011;2:170. 18.Pilatz S, Breitbach K, Hein N, et al. Identification of Burkholderia pseudomallei genes required for the intracellular life cycle and in vivo virulence. Infect Immun 2006;74:3576-86. 19.Boddey JA, Day CJ, Flegg CP, et al. The bacterial gene lfpA influences the potent induction of calcitonin receptor and osteoclast-related genes in Burkholderia pseudomallei-induced TRAP-positive multinucleated giant cells. Cell Microbiol 2007;9:514-31. 20.French CT, Toesca IJ, Wu TH, et al. Dissection of the Burkholderia intracellular life cycle using a photothermal nanoblade. Proc Natl Acad Sci U S A 2011; 108:12095-100. 21.Takeuchi O, Akira S. Pattern recognition receptors and inflammation. Cell 2010;140:805-20. 22.Wiersinga WJ, Wieland CW, Dessing MC, et al. Toll-like receptor 2 impairs host defense in gram-negative sepsis caused by Burkholderia pseudomallei (melioidosis). PLoS Med 2007;4(7):e248. 23.West TE, Chierakul W, Chantratita N, et al. Toll-like receptor 4 region genetic variants are associated with susceptibility to melioidosis. Genes Immun 2012;13:38-46. 24.Werts C, Tapping RI, Mathison JC, et al. Leptospiral lipopolysaccharide activates cell through a TLR2-dependent mechanism. Nat Immunol 2001;2:346-52. 25.West TE, Ernst RK, Jansson-Hutson MJ, Skerrett SJ. Activation of Toll-like receptors by Burkholderia pseudomallei. BMC Immunol 2008;9:46. 26.Wiersinga WJ, de Vos AF, Wieland CW, Leendertse M, Roelofs JJ, van der Poll T. CD14 impairs host defense against gram-negative sepsis caused by Burkholderia pseudomallei in mice. J Infect Dis 2008;198:1388-97. 27.Wiersinga WJ, Wieland CW, van der Windt GJ, et al. Endogenous interleukin-18 improves the early antimicrobial host response in severe melioidosis. Infect Immun 2007;75:3739-46. 28.Ceballos-Olvera I, Sahoo M, Miller MA, Del BL, Re F. Inflammasome-dependent pyroptosis and IL-18 protect against Burkholderia pseudomallei lung infection while IL-1β is deleterious. PLoS Pathog 2011;7(12):e1002452. 29.Haque A, Easton A, Smith D, et al. Role of T cells in innate and adaptive immunity against murine Burkholderia pseudomallei infection. J Infect Dis 2006;193:370-9. 30.Miao EA, Mao DP, Yudkovsky N, et al. Innate immune detection of the type III secretion apparatus through the NLRC4 inflammasome. Proc Natl Acad Sci U S A 2010;107:3076-80. 31.Sun GW, Lu J, Pervaiz S, Cao WP, Gan YH. Caspase-1 dependent macrophage death induced by Burkholderia pseudomallei. Cell Microbiol 2005;7:1447-58. 32.Easton A, Haque A, Chu K, Lukaszewski R, Bancroft GJ. A critical role for neutrophils in resistance to experimental infection with Burkholderia pseudomallei. J Infect Dis 2007;195:99-107. 33.Haque A, Chu K, Easton A, et al. A live experimental vaccine against Burkholderia pseudomallei elicits CD4+ T cell-mediated immunity, priming T cells specific for 2 type III secretion system proteins. J Infect Dis 2006;194:1241-8. 34.Chierakul W, Wuthiekanun V, Chaowagul W, et al. Disease severity and outcome of melioidosis in HIV coinfected individuals. Am J Trop Med Hyg 2005;73:1165-6. 35.Wiersinga WJ, Meijers JC, Levi M, et al. Activation of coagulation with concurrent impairment of anticoagulant mechanisms correlates with a poor outcome in severe melioidosis. J Thromb Haemost 2008;6: 32-9 36.Farkas Himsley, H.1968. Selection and rapid identification of Pseudomonas pseudomallei from other gram-negative bacteria.Am. J. Clin. Pathol.49:850-856. 37.Galimand, M., and A. Dodin.1982. Focus on melioidosis throughout the world.Bull. Soc. Pathol. Exot. Filiales75:375-383. 38.Ashdown, L. R.1979. An improved screening technique for isolation of Pseudomonas pseudomallei from clinical specimens.Pathology11:293-297. 39.Dance, D. A., V. Wuthiekanun, P. Naigowit, and N. J. White.1989. Identification of Pseudomonas pseudomallei in clinical practice: use of simple screening tests and API 20NE.J. Clin. Pathol.42:645-648. 40.Wuthiekanun, V., D. A. Dance, Y. Wattanagoon, Y. Supputtamongkol, W. Chaowagul, and N. J. White.1990. The use of selective media for the isolation of Pseudomonas pseudomallei in clinical practice.J. Med. Microbiol.33:121-126. 41.Howard, K., and T. J. Inglis.2003. Novel selective medium for isolation ofBurkholderia pseudomallei.J. Clin. Microbiol.41:3312-3316. 42.Tiangpitayakorn, C., S. Songsivilai, N. Piyasangthong, and T. Dharakul.1997. Speed of detection of Burkholderia pseudomallei in blood cultures and its correlation with the clinical outcome.Am. J. Trop. Med. Hyg.57:96-99. 43.Dance, D. A., N. J. White, Y. Suputtamongkol, Y. Wattanagoon, V. Wuthiekanun, and W. Chaowagul.1990. The use of bone marrow culture for the diagnosis of melioidosis.Trans. R. Soc. Trop. Med. Hyg.84:585-587. 44.Ismail, G., M. Noor Embi, O. Omar, J. C. Allen, and C. J. Smith.1987. A competitive immunosorbent assay for detection of Pseudomonas pseudomallei exotoxin.J. Med. Microbiol.23:353-357. 45.Wongratanacheewin, S., U. Tattawasart, and V. Lulitanond. 1990. An avidin-biotin enzyme-linked immunosorbent assay for the detection of Pseudomonas pseudomallei antigens.Trans. R. Soc. Trop. Med. Hyg. 84:429-430. 46.Wongratanacheewin, S., U. Tattawasart, V. Lulitanond, S. Wongwajana, R. W. Sermswan, M. Sookpranee, and K. Nuntirooj. 1993. Characterization of Pseudomonas pseudomallei antigens by SDS-polyacrylamide gel electrophoresis and Western blot. Southeast Asian J. Trop. Med. Public Health 24:107-113. 47.Dharakul, T., S. Songsivilai, S. Smithikarn, C. Thepthai, and A. Leelaporn.1999. Rapid identification of Burkholderia pseudomallei in blood cultures by latex agglutination using lipopolysaccharide-specific monoclonal antibody.Am. J. Trop. Med. Hyg.61:658-662. 48.Pongsunk, S., N. Thirawattanasuk, N. Piyasangthong, and P. Ekpo.1999. Rapid identification ofBurkholderia pseudomalleiin blood cultures by a monoclonal antibody assay.J. Clin. Microbiol.37:3662-3667. 49.Steinmetz, I., A. Reganzerowski, B. Brenneke, S. Haussler, A. Simpson, and N. J. White.1999. Rapid identification ofBurkholderia pseudomalleiby latex agglutination based on an exopolysaccharide-specific monoclonal antibody.J. Clin. Microbiol.37:225-228. 50.Desakorn, V., M. D. Smith, V. Wuthiekanun, D. A. Dance, H. Aucken, P. Suntharasamai, A. Rajchanuwong, and N. J. White.1994. Detection of Pseudomonas pseudomallei antigen in urine for the diagnosis of melioidosis.Am. J. Trop. Med. Hyg.51:627-633. 51.Sirisinha, S., N. Anuntagool, T. Dharakul, P. Ekpo, S. Wongratanacheewin, P. Naigowit, B. Petchclai, V. Thamlikitkul, and Y. Suputtamongkol.2000. Recent developments in laboratory diagnosis of melioidosis.Acta Trop.74:235-245. 52.Anuntagool, N., P. Naigowit, V. Petkanchanapong, P. Aramsri, T. Panichakul, and S. Sirisinha.2000. Monoclonal antibody-based rapid identification of Burkholderia pseudomallei in blood culture fluid from patients with community-acquired septicaemia.J. Med. Microbiol.49:1075-1078. 53.Naigowit, P., W. Petchkanchanapong, W. Mannebungyung, N. Vetchsprsit, and D. Chaeosil.1989. Indirect hemagglutination test for the diagnosis of melioidosis.Bull. Fac. Med. Tech. Mahidol. U.13:17-25. 54.Walsh, A. L., M. D. Smith, V. Wuthiekanun, Y. Suputtamongkol, V. Desakorn, W. Chaowagul, and N. J. White.1994. Immunofluorescence microscopy for the rapid diagnosis of melioidosis.J. Clin. Pathol.47:377-379. 55.Naigowit, P., T. Kurata, P. Wangroongsub, V. Petkanjanapong, E. Kondo, and K. Kanai.1993. Application of indirect immunofluorescence microscopy to colony identification of Pseudomonas pseudomallei.Asian Pac. J. Allergy Immunol.11:149-154. 56.Sirisinha, S., N. Anuntagool, P. Intachote, V. Wuthiekanun, S. D. Puthucheary, J. Vadivelu, and N. J. White.1998. Antigenic differences between clinical and environmental isolates of Burkholderia pseudomallei.Microbiol. Immunol.42:731-737. 57.Ileri, S.1965. The indirect haemagglutination tests in the diagnosis of melioidosis in goats.Br. Vet. J.121:164-170. 58.Ashdown, L. R.1987. Indirect haemagglutination test for melioidosis.Med. J. Aust.147:364-365. 59.Yap, E. H., Y. C. Chan, T. Y. Ti, T. W. Thong, A. L. Tan, M. Yeo, L. C. Ho, and M. Singh.1991. Serodiagnosis of melioidosis in Singapore by the indirect haemagglutination test.Singapore Med. J.32:211-213. 60.Nigg, C., and M. Johnson.1961. Complement fixation tests in experimental clinical and subclinical melioidosis.J. Bacteriol.82:159-168. 61.Khupulsup, K., and B. Petchclai.1986. Application of indirect hemagglutination test and indirect fluorescent antibody test for IgM antibody for diagnosis of melioidosis in Thailand.Am. J. Trop. Med. Hyg.35:366-369. 62.Anuntagool, N., P. Intachote, V. Wuthiekanun, N. J. White, and S. Sirisinha.1998. Lipopolysaccharide from nonvirulent Ara+Burkholderia pseudomalleiisolates is immunologically indistinguishable from lipopolysaccharide from virulent Ara−clinical isolates.Clin. Diagn. Lab. Immunol.5:225-229. 63.Kanaphun, P., N. Thirawattanasuk, Y. Suputtamongkol, P. Naigowit, D. A. Dance, M. D. Smith, and N. J. White.1993. Serology and carriage of Pseudomonas pseudomallei: a prospective study in 1000 hospitalized children in northeast Thailand.J. Infect. Dis.167:230-233. 64.Ashdown, L. R., and R. W. Guard.1984. The prevalence of human melioidosis in Northern Queensland.Am. J. Trop. Med. Hyg.33:474-478. 65.Leelarasamee, A.1985. Diagnostic value of indirect hemagglutination method for melioidosis in Thailand.J. Infect. Dis. Antimicrob. Agents2:213-214. 66.Naigowit, P., W. Petchkanchanapong, W. Mannebungyung, N. Vetchsprsit, and D. Chaeosil.1989. Indirect hemagglutination test for the diagnosis of melioidosis.Bull. Fac. Med. Tech. Mahidol. U.13:17-25. 67.Ashdown, L. R.1981. Relationship and significance of specific immunoglobulin M antibody response in clinical and subclinical melioidosis.J. Clin. Microbiol.14:361-364. 68.Khupulsup, K., and B. Petchclai.1986. Application of indirect hemagglutination test and indirect fluorescent antibody test for IgM antibody for diagnosis of melioidosis in Thailand.Am. J. Trop. Med. Hyg.35:366-369. 69.Dharakul, T., S. Songsivilai, N. Anuntagool, W. Chaowagul, S. Wongbunnate, P. Intachote, and S. Sirisinha.1997. Diagnostic value of an antibody enzyme-linked immunosorbent assay using affinity-purified antigen in an area endemic for melioidosis.Am. J. Trop. Med. Hyg.56:418-423. 70.Appassakij, H., K. R. Silpapojakul, R. Wansit, and M. Pornpatkul.1990. Diagnostic value of the indirect hemagglutination test for melioidosis in an endemic area.Am. J. Trop. Med. Hyg.42:248-253. 71.Anuntagool, N., P. Aramsri, T. Panichakul, V. R. Wuthiekanun, R. Kinoshita, N. J. White, and S. Sirisinha.2000. Antigenic heterogeneity of lipopolysaccharide among Burkholderia pseudomallei clinical isolates.Southeast Asian J. Trop. Med. Public Health31:146-152. 72.Sermswan, R. W., S. Wongratanacheewin, N. Anuntagool, and S. Sirisinha.2000. Comparison of the polymerase chain reaction and serologic tests for diagnosis of septicemic melioidosis.Am. J. Trop. Med. Hyg.63:146-149. 73.Cuzzubbo, A. J., V. Chenthamarakshan, J. Vadivelu, S. D. Puthucheary, D. Rowland, and P. L. Devine.2000. Evaluation of a new commercially available immunoglobulin M and immunoglobulin G immunochromatographic test for diagnosis of melioidosis infection.J. Clin. Microbiol.38:1670-1671. 74.Freeman, K., G. Lum, and J. De Boer.2000. Presented at the Australian Society of Microbiology, Cairns. 75.Wuthiekanun, V., P. Amornchai, W. Chierakul, A. C. Cheng, N. J. White, S. J. Peacock, and N. P. Day.2004. Evaluation of immunoglobulin M (IgM) and IgG rapid cassette test kits for diagnosis of melioidosis in an area of endemicity.J. Clin. Microbiol.42:3435-3437. 76.O'Brien, M., K. Freeman, G. Lum, A. C. Cheng, S. P. Jacups, and B. J. Currie.2004. Further evaluation of a rapid diagnostic test for melioidosis in an area of endemicity.J. Clin. Microbiol.42:2239-2240. 77.Brook, M. D., B. Currie, and P. M. Desmarchelier.1997. Isolation and identification ofBurkholderia pseudomalleifrom soil using selective culture techniques and the polymerase chain reaction.J. Appl. Microbiol.82:589-596. 78.Dharakul, T., S. Songsivilai, S. Viriyachitra, V. Luangwedchakarn, B. Tassaneetritap, and W. Chaowagul.1996. Detection ofBurkholderia pseudomalleiDNA in patients with septicemic melioidosis.J. Clin. Microbiol.34:609-614. 79.Kunakorn, M., and R. B. Markham.1995. Clinically practical seminested PCR forBurkholderia pseudomalleiquantitated by enzyme immunoassay with and without solution hybridization.J. Clin. Microbiol.33:2131-2135. 80.Kunakorn, M., K. Raksakait, C. Sethaudom, R. W. Sermswan, and T. Dharakul.2000. Comparison of three PCR primer sets for diagnosis of septicemic melioidosis.Acta Trop.74:247-251. 81.Haase, A., M. Brennan, S. Barrett, Y. Wood, S. Huffam, D. O′Brien, and B. Currie.1998. Evaluation of PCR for diagnosis of melioidosis.J. Clin. Microbiol.36:1039-1041. 82.Smith-Vaughan, H. C., D. Gal, P. M. Lawrie, C. Winstanley, K. S. Sriprakash, and B. J. Currie.2003. Ubiquity of putative type III secretion genes among clinical and environmentalBurkholderia pseudomalleiisolates in Northern Australia.J. Clin. Microbiol.41:883-885. 83.Gee, J. E., C. T. Sacchi, M. B. Glass, B. K. De, R. S. Weyant, P. N. Levett, A. M. Whitney, A. R. Hoffmaster, and T. Popovic.2003. Use of 16S rRNA gene sequencing for rapid identification and differentiation ofBurkholderia pseudomalleiandB. mallei.J. Clin. Microbiol.41:4647-4654. 84. Brett, P. J., D. DeShazer, and D. E. Woods. 1998.Burkholderia thailandensis sp. nov., a Burkholderia pseudomallei-like species. Int. J. Syst. Bacteriol. 48:317-320. 85. Brett, P. J., D. Deshazer, and D. E. Woods. 1997. Characterization of Burkholderia pseudomallei and Burkholderia pseudomallei-like strains. Epidemiol. Infect. 118:137-148. 86. Woo, P. C., S. K. Lau, G. K. Woo, A. M. Fung, A. H. Ngan, W. T. Hui, and K. Y. Yuen. 2003. Seronegative bacteremic melioidosis caused by Burkholderia pseudomallei with ambiguous biochemical profile: clinical importance of accurate identification by 16S rRNA gene and groEL gene sequencing. J. Clin. Microbiol.41:3973-3977. 87. Woo, P. C., G. K. Woo, S. K. Lau, S. S. Wong, and K. Yuen. 2002. Single gene target bacterial identification. groEL gene sequencing for discriminating clinical isolates of Burkholderia pseudomallei and Burkholderia thailandensis. Diagn. Microbiol. Infect. Dis. 44:143-149. 88.Stanton AT, Fletcher W (1921). "Melioidosis, a new disease of the tropics". Far Eastern Association of Tropical Medicine: Transactions of the Fourth Congress. Batavia, Dutch East Indies: Javasche Boekhandel en Drukkerij. 89.A J Simpson; Suputtamongkol Y; Smith MD; et al. (1999). "Comparison of imipenem and ceftazidime as therapy for severe melioidosis". Clin Infect Dis. 29 (2): 381-387. 90.Ngauy V, Lemeshev Y, Sadkowski L, Crawford G (2005). "Cutaneous Melioidosis in a Man Who Was Taken as a Prisoner of War by the Japanese during World War II". J Clin Microb. 43 (2): 970–2. 91.Apisarnthanarak A, Apisarnthanarak P, Mundy LM (2006). "Computer tomography characteristics of Burkholderia pseudomallei liver abscess". Clin Infect Dis. 42 (7): 989-93 92.Laopaiboon V, Chamadol N, Buttham H, Sukeepaisarnjareon W (2009). "CT findings of liver and splenic abscesses in melioidosis: comparison with those in non-melioidosis". J Med Assoc Thai. 92 (11): 1476–84. 93.Dance DA, Davis TM, Wattanagoon Y, et al. (1989). "Acute suppurative parotitis caused by Pseudomonas pseudomallei in children". J Infect Dis. 159 (4): 654–60. 94.Raja, NS; Ahmed MZ; Singh NN (1 April 2005). "Melioidosis: an emerging infectious disease". Journal of Postgraduate Medicine. 51 (2): 140-45. 95.Chlebicki, MP; Tan BH (2006). "Six cases of suppurative lymphadenitis caused by Burkholderia pseudomallei infection". Trans R Soc Trop Med Hyg. 100 (8): 798-801. 96.Currie BJ, Fisher DA, Howard DM, et al. (2000). Endemic melioidosis in tropical northern Australia: a 10-year prospective study and review of the literature". Clin Infect Dis. 31 (4): 981-986. 97.Falade OO, Antonarakis ES, Kaul DR, Saint S, Murphy PA (2008). "Clinical problem-solving. Beware of first impressions". N Engl J Med. 359 (6): 628–634. 98.Chetchotisakd, P; Anunnatsiri, S; Kiatchoosakun, S; Kularbkaew, C (2010). "Melioidosis pericarditis mimicking tuberculous pericarditis". Clin Infect Dis. 51 (5): e46–9. 99.Suntornsut P, Kasemsupat K, Silairatana S, et al. (2013). "Prevalence of Melioidosis in Patients with Suspected Pulmonary Tuberculosis and Sputum Smear Negative for Acid-Fast Bacilli in Northeast Thailand". Am J Trop Med Hyg. 89 (5): 983-5. 100.Ngauy V, Lemeshev Y, Sadkowski L, Crawford G (2005). "Cutaneous Melioidosis in a Man Who Was Taken as a Prisoner of War by the Japanese during World War II". J Clin Microbiol. 43 (2): 970–972. 101.Wuthiekanun V, Suputtamongkol Y, Simpson AJ, Kanaphun P, White NJ (2001). "Value of Throat Swab in Diagnosis of Melioidosis". J Clin Microbiol. 39 (10): 3801-02. 102.Limmathurotsakul D, Wuthiekanun V, Chierakul W, et al. (2005). "Role and Significance of Quantitative Urine Cultures in Diagnosis of Melioidosis". J Clin Microb. 43 (5): 2274-76. 103.Dance DA, White NJ, Suputtamongkol Y, Wattanagoon Y, Wuthiekanun V, Chaowagul W (1990). "The use of bone marrow culture for the diagnosis of melioidosis". Trans R Soc Trop Med Hyg. 84 (4): 585–7. 104.Peacock SJ, Chieng G, Cheng AC, et al. (2005). "Comparison of Ashdown's Medium, Burkholderia cepacia Medium, and Burkholderia pseudomallei Selective Agar for Clinical Isolation of Burkholderia pseudomallei". J Clin Microbiol. 43 (10): 5359-61. 105.Francis A, Aiyar S, Yean C, Naing L, Ravichandran M (2006). "An improved selective and differential medium for the isolation of Burkholderia pseudomallei from clinical specimens". Diagn Microbiol Infect Dis. 55 (2): 95–99. 106.Puthucheary SD, Anuar AS, Tee TS (2010). "Burkholderia thailandensis whole cell antigen cross-reacts with B. pseudomallei antibodies from patients with melioidosis in an immunofluorescent assay". The Southeast Asian journal of tropical medicine and public health. 41 (2): 397–400. 107.Limmathurotsakul D, Chantratita N, Teerawattanasook N, et al. (2011). "Enzyme-Linked Immunosorbent Assay for the Diagnosis of Melioidosis: Better Than We Thought". Clin Infect Dis. 52 (8): 1024–8. 108.Peacock SJ, Cheng AC, Currie BJ, Dance DA (2011). "The Use of Positive Serological Tests as Evidence of Exposure to Burkholderia pseudomallei". Am J Trop Med Hyg. 84 (6): 1021-2. 109.Lim KS, Chong VH (2010). "Radiological manifestations of melioidosis". Clin Radiol. 65 (1): 66–72. 110.Muttarak M, Peh WC, Euathrongchit J, Lin SE, Tan AG, Lerttumnongtum P, Sivasomboon C (2008). "Spectrum of imaging findings in melioidosis". Br J Radiol. 82 (978): 514-21. 111.White NJ, Dance DA, Chaowagul W, et al. (1989). "Halving of mortality of severe melioidosis by ceftazidime". Lancet. 2 (8665): 697–701. 112.Chierakul W, Anunnatsiri S, Chaowagul W, et al. (2007). "Addition of trimethoprim-sulfamethoxazole to ceftazidime during parenteral treatment of melioidosis is not associated with a long-term outcome benefit". Clin Infect Dis. 45 (4): 521–523. 113.Cheng AC, Fisher DA, Anstey NM, et al. (2004). "Outcomes of Patients with Melioidosis Treated with Meropenem". Antimicrob Agents Chemother. 48 (5): 1763–65. 114.Chetchotisakd P, Porramatikul S, Mootsikapun P, Anunnatsiri S, Thinkhamrop B (2001). "Randomized, double-blind, controlled study of cefoperazone-sulbactam plus cotrimoxazole versus ceftazidime plus cotrimoxazole for the treatment of severe melioidosis". Clin Infect Dis. 33 (1): 29–3. 115.Dance DA, Wuthiekanun V, White NJ, Chaowagul W (1988). "Antibiotic resistance in Pseudomonas pseudomallei". Lancet. 1 (8592): 994–5. 116.Suputtamongkol Y, Rajchanuwong A, Chaowagul W, et al. (1994). "Ceftazidime vs. amoxicillin/clavulanate in the treatment of severe melioidosis". Clin Infect Dis. 19 (5): 846–53. 117.University of Oxford (18 December 2007). "A randomized double blinded comparison of ceftazidime and meropenem in severe melioidosis (ATOM)". ClinicalTrials.gov. National Institutes of Health. Retrieved 27 Jan 2011. 118.Simpson, A. J. H.; Opal, S. M.; Angus, B. J.; Prins, J. M.; Palardy, J. E.; Parejo, N. A.; Chaowagul, W.; White, N. J. (2000). "Differential antibiotic-induced endotoxin release in severe melioidosis". J Infect Dis. 181 (3): 1014–9. 119.Bilgrami, I.; Roberts, J. A.; Wallis, S. C.; Thomas, J.; Davis, J.; Fowler, S.; Goldrick, P. B.; Lipman, J. (2010). "Meropenem Dosing in Critically Ill Patients with Sepsis Receiving High-Volume Continuous Venovenous Hemofiltration". Antimicrobial Agents and Chemotherapy. 54 (7): 2974–2978. 120.Shih H-I; Chuang Y-C; Cheung BM-H; et al. (February 2008). "Sporadic and outbreak cases of melioidosis in southern Taiwan: clinical features and antimicrobial susceptibility". Infection. 37 (1): 9-15. 121.Harris P, Engler C, Norton R (2011). "Comparative in vitro susceptibility of Burkholderia pseudomallei to doripenem, ertapenem, tigecycline and moxifloxacin". Int J Antimicrob Agents. 37 (6): 547–9. 122.Thamlikitkul V, Trakulsomboon S (2010). "In vitro activity of biapenem against Burkholderia pseudomallei". Int J Antimicrob Agents. 35 (5): 514. doi:10.1016/j.ijantimicag.2010.01.002. PMID 20188524. 123.Cheng AC, Limmathurotsakul D, Chierakul W, et al. (2007). "A randomized controlled trial of granulocyte colony-stimulating factor for the treatment of severe sepsis due to melioidosis in Thailand". Clin Infect Dis. 45 (3): 308–14. doi:10.1086/519261. PMID 17599307. 124.Chierakul W, Anunnatsiri S, Short JM, et al. (2005). "Two randomized controlled trials of ceftazidime alone versus ceftazidime in combination with trimethoprim-sulfamethoxazole for the treatment of severe melioidosis". Clin Infect Dis. 41 (8): 1105–13. doi:10.1086/444456. PMID 16163628. 125.Chierakul W, Anunnatsiri S, Chaowagul W, Peacock SJ, Chetchotisakd P, Day NP (2007). "Addition of trimethoprim-sulfamethoxazole to ceftazidime during parenteral treatment of melioidosis is not associated with a tong-term outcome benefit". Clin Infect Dis. 45 (4): 521–3. doi:10.1086/520010. PMID 17638209. 126.Chaowagul W, Simpson AJ, Suputtamongkol Y, et al. (1999). "A comparison of chloramphenicol, trimethoprim-sulfamethoxazole, and doxycycline with doxycycline alone as maintenance therapy for melioidosis". Clin Infect Dis. 29 (2): 375–80. doi:10.1086/520218. PMID 10476745. 127.Rajchanuvong A, Chaowagul W, Suputtamongkol Y, Smith MD, Dance DA, White NJ (1995). "A prospective comparison of co-amoxiclav and the combination of chloramphenicol, doxycycline, and co-trimoxazole for the oral maintenance treatment of melioidosis". Trans R Soc Trop Med Hyg. 89 (5): 546–9. doi:10.1016/0035-9203(95)90104-3. PMID 8560537. 128.Cheng AC, Chierakul W, Chaowagul W, et al. (2008). "Short Report: Consensus Guidelines for Dosing of Amoxicillin-Clavulanate in Melioidosis". Am J Trop Med Hyg. 78 (2): 208–9. PMC 3034162 . PMID 18256414. 129.Chaowagul W, Supputtamongkul Y, Smith MD, White NJ (1997). "Oral fluoroquinolones for maintenance treatment of melioidosis". Trans R Soc Trop Med Hyg. 91 (5): 599–601. doi:10.1016/S0035-9203(97)90044-4. PMID 9463680. 130.Chetchotisakd P, Chaowagul W, Mootsikapun P, Budhsarawong D, Thinkamrop B (Jan–Feb 2001). "Maintenance therapy of melioidosis with ciprofloxacin plus azithromycin compared with cotrimoxazole plus doxycycline". Am J Trop Med Hyg. 64 (1–2): 24–7. PMID 11425157. 131.Chaowagul W,; Simpson, Andrew J. H.; Suputtamongkol, Yupin; Smith, Michael D.; Angus, Brian J.; White, Nicholas J. (August 1999). "Clin Infect Dis". Clinical Infectious Diseases. 29 (2): 375–380. doi:10.1086/520218. PMID 10476745. 132.Limmathurotsakul D; Chaowagul W; Chierakul Wirongrong; et al. (2006). "Risk factors for recurrent melioidosis in Northeastern Thailand". Clin Infect Dis. 43 (8): 979–86. doi:10.1086/507632. PMID 16983608. 133.Dance DA, Wuthiekanun V, Chaowagul W, White NJ (1989). "Interactions in vitro between agents used to treat melioidosis". J Antimicrob Chemother. 24 (3): 311–6. doi:10.1093/jac/24.3.311. PMID 2681117. 134.Chetchotisakd, P; Chierakul, W; Chaowagul, W; Anunnatsiri, S; Phimda, K; Mootsikapun, P; Chaisuksant, S; Pilaikul, J; Thinkhamrop, B; Phiphitaporn, S; Susaengrat, W; Toondee, C; Wongrattanacheewin, S; Wuthiekanun, V; Chantratita, N; Thaipadungpanit, J; Day, NP; Limmathurotsakul, D; Peacock, SJ (1 March 2014). "Trimethoprim-sulfamethoxazole versus trimethoprim-sulfamethoxazole plus doxycycline as oral eradicative treatment for melioidosis (MERTH): a multicentre, double-blind, non-inferiority, randomised controlled trial.". Lancet (London, England). 383 (9919): 807–14. doi:10.1016/S0140-6736(13)61951-0. PMC 3939931 . PMID 24284287. 135.Cheng AC, McBryde ES, Wuthiekanun V, Chierakul W, Amornchai P, Day NP, Peacock SJ (2009). "Dosing Regimens of Cotrimoxazole (Trimethoprim-Sulfamethoxazole) for Melioidosis". Antimicrob Agents Chemother. 53 (10): 4193–9. doi:10.1128/AAC.01301-08. PMC 2764189 . PMID 19620336. 136.TJ Inglis; CL Golledge; A Clair; J Harvey (2001). "Case report: recovery from persistent septicemic melioidosis". Am J Trop Med Hyg. 65 (1): 76–82. PMID 11504412. 137.Dance DA, Wuthiekanun V, Chaowagul W, White NJ (1989). "Interactions in vitro between agents used to treat melioidosis". J Antimicrob Chemother. 24 (3): 311–6. doi:10.1093/jac/24.3.311. PMID 2681117. 138.Couture E (1935). Rev Hyg Méd Prèv. 57: 190.|title= 139.Warner JM, Pelowa DB, Currie BJ, Hirst RG (2007). "Melioidosis in a rural community of Western Province, Papua New Guinea". Trans R Soc Trop Med Hyg. 101 (8): 809–13. doi:10.1016/j.trstmh.2007.02.024. PMID 17499321. 140.White NJ (2003). "Melioidosis". Lancet. 361 (9370): 1715–22. doi:10.1016/S0140-6736(03)13374-0. PMID 12767750. 141.Chaowagul W, White NJ, Dance DA, et al. (1989). "Melioidosis: a major cause of community-acquired septicemia in northeastern Thailand". J Infect Dis. 159 (5): 890–9. doi:10.1093/infdis/159.5.890. PMID 2708842. 142.Sarovich DS, Ward L, Price EP, et al. (2014). "Recurrent melioidosis in the Darwin Prospective Melioidosis Study: improving therapies mean that relapse cases are now rare.". J Clin Microbiol. 52 (2): 650–3. doi:10.1128/JCM.02239-13. PMID 24478504. 143.Maharjan B, Chantratita N, Vesaratchavest M, et al. (2005). "Recurrent Melioidosis in Patients in Northeast Thailand Is Frequently Due to Reinfection Rather than Relapse". J Clin Microbiol. 43 (12): 6032–4. doi:10.1128/JCM.43.12.6032-6034.2005. PMC 1317219 . PMID 16333094. 144.Chaowagul W, Suputtamongkol Y, Dance DA, Rajchanuvong A, Pattara-arechachai J, White NJ (1993). "Relapse in melioidosis: incidence and risk factors". J Infect Dis. 168 (5): 1181–85. doi:10.1093/infdis/168.5.1181. PMID 8228352. 145.Holland DJ, Wesley A, Drinkovic D, Currie BJ (2002). "Cystic fibrosis and Burkholderia pseudomallei infection: an emerging problem?". Clin Infect Dis. 35 (12): e138–40. doi:10.1086/344447. PMID 12471591. 146.McCormick J B (1975). "Human-to-human transmission of Pseudomonas pseudomallei". Annals of Internal Medicine. 83 (4): 512–513. doi:10.7326/0003-4819-83-4-512. 147.Kunakorn M, Jayanetra P, Tanphaichitra D (1991). "Man-to-man transmission of melioidosis". Lancet. 337 (8752): 1290–1. doi:10.1016/0140-6736(91)92962-2. PMID 1674089. 148.Centers for Disease Control and Prevetion (2009). Biosafety in Microbiological and Biomedical Laboratories (5th ed.). Atlanta, Georgia: National Institutes of Health. 149.Sivalingam SP, Sim SH, Jasper LC, et al. (2008). "Pre- and post-exposure prophylaxis of experimental Burkholderia pseudomallei infection with doxycycline, amoxicillin/clavulanic acid and co-trimoxazole". J Antimicrob Chemother. 61 (3): 674–8. doi:10.1093/jac/dkm527. PMID 18192684. 150.Peacock SJ, Schweizer HP, Dance DA, et al. (2008). "Management of Accidental Laboratory Exposure to Burkholderia pseudomallei and B. mallei". Emerg Infect Dis. 14 (7): e2. doi:10.3201/eid1407.071501. PMC 2600349 . PMID 18598617. 151.Kenny DJ, Sefton AM, Brooks TJ, Laws TR, Simpson AJ, Atkins HS (2010). "Evaluation of azithromycin, trovafloxacin and grepafloxacin as prophylaxis for experimental murine melioidosis". Int J Antimicrob Agents. 36 (1): 87–9. doi:10.1016/j.ijantimicag.2010.03.019. PMID 20462743. 152.CDC Disease Info melioidosis 153.Withers MR (ed.) (2014). USAMRIID's Medical Management of Biological Casualties Handbook (PDF) (8th ed.). Fort Detrick, Maryland: U.S. Army Medical Institute of Infectious Diseases. p. 53. 154.V Vuddhakul; et al. (1999). "Epidemiology of Burkholderia pseudomallei in Thailand". Am J Trop Med Hyg. 60 (3): 458–461. 155.Wuthiekanun V, Mayxay M, Chierakul W, Phetsouvanh R, Cheng AC, White NJ, Day NP, Peacock SJ (2005). "Detection of Burkholderia pseudomallei in soil within the Lao People's Democratic Republic". J Clin Microbiol. 43 (2): 923–4. doi:10.1128/JCM.43.2.923-924.2005. PMC 548109 . PMID 15695707. 156.Rattanavong S, Wuthiekanun V, Langla S, Amornchai P, Sirisouk J, Phetsouvanh R, Moore CE, Peacock SJ, Buisson Y, Newton PN (2010). "Randomized Soil Survey of the Distribution of Burkholderia pseudomallei in Rice Fields in Laos". Applied and Environmental Microbiology. 77 (2): 532–6. doi:10.1128/AEM.01822-10. PMC 3020526 . PMID 21075883. 157.Vongphayloth K, Rattanavong S, Moore CE, Phetsouvanh R, Wuthiekanun V, Sengdouangphachanh A, Phouminh P, Newton PN, Buisson Y (2012). "Burkholderia pseudomallei detection in surface water in southern Laos using Moore's swabs.". Am J Trop Med Hyg. 86 (5): 872–7. doi:10.4269/ajtmh.2012.11-0739. PMC 3335696 . PMID 22556090. 158.Lo TJ, Ang LW, James L, Goh KT (2009). "Melioidosis in a Tropical City State, Singapore". Emerg Infect Dis. 15 (10): 1645–7. doi:10.3201/eid1510.090246. PMC 2866399 . PMID 19861063. 159.Kadir KA, Satyavani M, Pande K (2014). "Melioidosis: Antibiogram of cases in Brunei Darussalam." (PDF). Brunei International Medical Journal. 10 (1): 19–24. 160.Yang S (2000). "Melioidosis research in China". Acta Tropica. 77 (2): 157–165. doi:10.1016/S0001-706X(00)00139-X. 161.Ko, WC; Cheung, BM; Tang, HJ; Shih, HI; Lau, YJ; Wang, LR; Chuang, YC (2007). "Melioidosis Outbreak after Typhoon, Southern Taiwan". Emerg Infect Dis. 13 (6): 896–8. doi:10.3201/eid1306.060646. PMC 2792857 . PMID 17553230. 162.Chen YS, Lin HH, Mu JJ, Chiang CS, Chen CH, Buu LM, Lin YE, Chen YL (2010). "Distribution of Melioidosis Cases and Viable Burkholderia pseudomallei in Soil: Evidence for Emerging Melioidosis in Taiwan". J Clin Microbiol. 48 (4): 1432–4. doi:10.1128/JCM.01720-09. PMC 2849618 . PMID 20147639. 163.Cheng AC, Currie BJ (2005). "Melioidosis: Epidemiology, Pathophysiology, and Management". Clin Microbiol Rev. 18 (2): 383–416. doi:10.1128/CMR.18.2.383-416.2005. PMC 1082802 . PMID 15831829. 164.Chong VH (2010). "Changing spectrum of microbiology of liver abscess: Now Klebsiella, next Burkholderia pseudomallei". J Emerg Med. 41 (6): 676–677. doi:10.1016/j.jemermed.2009.10.027. PMID 20079999. 165.Chugh TD (2008). "Emerging and re-emerging bacterial diseases in India". J Biosci. 33 (4): 549–55. doi:10.1007/s12038-008-0073-0. PMID 19208980. 166.Antony B, Pinto H, Dias M, Shetty AK, Scaria B, Kuruvilla T, Boloor R (2010). "Spectrum of melioidosis in the suburbs of Mangalore, S West Coast of India". Southeast Asian J Trop Med Public Health. 41 (1): 169–74. 167.Vidyalakshmi K, Chakrapani M, Shrikala B, Damodar S, Lipika S, Vishal S (2008). "Tuberculosis mimicked by melioidosis". Int J Tuberc Lung Dis. 12 (10): 1209–15. 168.Prakash A, Thavaselvam D, Kumar A et al. (2014). "Isolation, identification and characterization of Burkholderia pseudomallei from soil of coastal region of India.". Springerplus. 3: 438. doi:10.1186/2193-1801-3-438. PMC 4152474 . PMID 25187882. 169.Inglis TJ, Rolim DB, De Queroz Sousa A (2006). "Melioidosis in the Americas". Am J Trop Med Hyg. 75 (5): 947–954. PMID 17123994. 170.O'Sullivan BP, Torres B, Conidi G, et al. (2011). "Burkholderia pseudomallei infection in a child with cystic fibrosis: acquisition in the western hemisphere". Chest. 140 (1): 239–42. doi:10.1378/chest.10-3336. PMID 21729895. 171.Brilhante RS, Bandeira TJ, Cordeiro RA, et al. (2012). "Clinical-epidemiological features of 13 cases of melioidosis in Brazil". J Clin Microbiol. 50 (10): 3349–52. doi:10.1128/JCM.01577-12. PMID 22814457. 172.Katangwe T, Purcell J, Bar-Zeev N, Denis B, Montgomery J, Alaerts M, Heyderman RS, Dance DA, Kennedy N, Feasey N, Moxon CA (2013). "Human melioidosis, Malawi, 2011.". Emerg Infect Dis. 19 (6): 981–4. doi:10.3201/eid1906.120717. PMID 23735189. 173.Morosini MI, Quereda C, Gil H, Anda P, Núñez-Murga M, Cantón R, López-Vélez R.; Quereda; Gil; Anda; Núñez-Murga; Cantón; López-Vélez (2013). "Melioidosis in traveler from Africa to Spain". Emerg Infect Dis. 19 (10): 1656–9. doi:10.3201/eid1910.121785. PMC 3810733 . PMID 24047798. 174.Struelens MJ, Mondol G, Bennish M, Dance DA (1998). "Melioidosis in Bangladesh: a case report". Trans R Soc Trop Med Hygiene. 82 (5): 777–78. doi:10.1016/0035-9203(88)90234-9. 175.Hosen, Akram (30 Jul 2013). "Deadly bacteria in Gozipur soil". The Daily Star. Dhaka, Bangladesh. Archived from the original on 30 Aug 2013. Retrieved 30 Aug 2013. 176.Dance DA, Smith MD, Aucken HM, Pitt TL (1999). "Imported melioidosis in England and Wales". Lancet. 353 (9148): 208. doi:10.1016/S0140-6736(05)77217-2. PMID 9923882. 177."Burkholderia pseudomallei" (PDF). Mahout Microbiology Review. 7: 4. 2013. Retrieved 24 April 2016. 178.Limmathurotsakul, Direk; Golding, Nick; Dance, David A. B.; Messina, Jane P.; Pigott, David M.; Moyes, Catherine L.; Rolim, Dionne B.; Bertherat, Eric; Day, Nicholas P. J.; Peacock, Sharon J.; Hay, Simon I. (11 January 2016). "Predicted global distribution of Burkholderia pseudomallei and burden of melioidosis". Nature Microbiology. 1 (1): 15008. doi:10.1038/nmicrobiol.2015.8. 179.Limmathurotsakul D, Wongratanacheewin S, Teerawattanasook N (2010). "Increasing Incidence of Human Melioidosis in Northeast Thailand". Am J Trop Med Hyg. 82 (6): 1113–7. doi:10.4269/ajtmh.2010.10-0038. PMC 2877420 . PMID 20519609. 180.Kanaphun P, Thirawattanasuk N, Suputtamongkol Y, et al. (1993). "Serology and carriage of Pseudomonas pseudomallei: a prospective study in 1000 hospitalized children in northeast Thailand". J Infect Dis. 167 (1): 230–3. doi:10.1093/infdis/167.1.230. PMID 7678106. 181.Vuddhakul V, Tharavichitkul P, Na-Ngam N, et al. (March 1999). Am. J. Trop. Med. Hyg. 60 (3): 458–61. PMID 10466977. 182.Kanai K, Dejsirilert S (August 1988). "Pseudomonas pseudomallei and melioidosis, with special reference to the status in Thailand". Jpn. J. Med. Sci. Biol. 41 (4): 123–57. doi:10.7883/yoken1952.41.123. PMID 3075004. 183.Yang S, Tong S, Mo C, et al. (1998). "Prevalence of human melioidosis on Hainan Island in China". Microbiol. Immunol. 42 (9): 651–4. doi:10.1111/j.1348-0421.1998.tb02335.x. PMID 9802565. 184.Chen YS, Chen SC, Wu TR, Kao CM, Chen YL (October 2004). "Seroprevalence of anti-flagellin antibody against Burkholderia pseudomallei in Taiwan". Jpn. J. Infect. Dis. 57 (5): 224–5. PMID 15507783. 185.Parkes, Helen M.; Shilton, Catherine M.; Jerrett, Ian V.; Benedict, Suresh; Spratt, Brian G.; Godoy, Daniel; O'Brien, Carolyn R.; Krockenberger, Mark B.; et al. (2009). "Primary ocular melioidosis due to a single genotype of Burkholderia pseudomallei in two cats from Arnhem Land in the Northern Territory of Australia". J Feline Med Surg. 11 (10): 856–63. doi:10.1016/j.jfms.2009.02.009. PMID 19428280. 186.Sprague LD, Neubauer H (2004). "Melioidosis in Animals: A review on epizootiology, diagnosis and clinical presentation". J Vet Med B Infect Dis Vet Public Health. 51 (7): 305–20. doi:10.1111/j.1439-0450.2004.00797.x. PMID 15525357. 187.Mollaret HH (1988). ""L'affaire du Jardin des plantes" ou comment le mélioïdose fit son apparition en France". Médecine et Maladies Infectieuses. 18 (Suppl 4): 643–54. doi:10.1016/S0399-077X(88)80175-6. 188.Corkeron ML, Norton R, Nelson PN (2010). "Spatial analysis of melioidosis distribution in a suburban area". Epidemiol Infect. 22 (9): 1–7. doi:10.1017/S0950268809991634. PMID 20092666. 189.Chantratita N, Wuthiekanun V, Limmathurotsakul D, et al. (2008). Currie B, ed. "Genetic Diversity and Microevolution of Burkholderia pseudomallei in the Environment". PLoS Negl Trop Dis. 2 (2): e182. doi:10.1371/journal.pntd.0000182. PMC 2254201. PMID 18299706. 190.Lin HH; Chen YS; Li YC; e al. (2011). "Burkholderia multivorans acts as an antagonist against the growth of Burkholderia pseudomallei in soil". Microbiol Immunol. 55 (9): 616–24. doi:10.1111/j.1348-0421.2011.00365.x. PMID 21752084. 191.Inglis TJ, Garrow SC, Henderson M, Clair A, Sampson J, O'Reilly L, Cameron B (2000). "Burkholderia pseudomallei traced to water treatment plant in Australia". Emerg Infect Dis. 6 (1): 56–59. doi:10.3201/eid0601.000110. PMC 2627980. PMID 10653571. 192.Apisarnthanarak A, Khawcharoenporn T, Mundy LM (2012). "Flood-associated melioidosis in a non-endemic region of Thailand". Int J Infect Dis. 16 (5): e409–10. doi:10.1016/j.ijid.2012.01.013. PMID 22421023. 193.Chierakul W, Winothai W, Wattanawaitunechai C, et al. (2005). "Melioidosis in 6 tsunami survivors in southern Thailand". Clin Infect Dis. 41 (7): 982–90. doi:10.1086/432942. PMID 16142663. 194.Ko WC, Cheung BM, Tang HJ, Shih HI, Lau YJ, Wang LR, Chuang YC (2007). "Melioidosis outbreak after typhoon, southern Taiwan". Emerg Infect Dis. 13 (6): 896–8. doi:10.3201/eid1306.060646. PMC 2792857 . PMID 17553230. 195.Inglis TJ, O'Reilly L, Merritt AJ, Levy A, Heath CH (2011). "The aftermath of the Western Australian melioidosis outbreak.". Am J Trop Med Hyg. 84 (6): 851–7. doi:10.4269/ajtmh.2011.10-0480. PMID 21633018. 196.Baker A, Pearson T, Price EP, et al. (2011). "Molecular Phylogeny of Burkholderia pseudomallei from a Remote Region of Papua New Guinea". PLoS onE. 6 (3): e18343. doi:10.1371/journal.pone.0018343. PMC 3069084. PMID 21483841. 197.Suputtamongkol Y, Chaowagul W, Chetchotisakd P, et al. (1999). "Risk factors for melioiosis and bacteremic melioidosis". Clin Infect Dis. 29 (2): 408–13. doi:10.1086/520223. PMID 10476750. 198.Phe T, Vlieghe E, Reid T, et al. (2013). "Does HIV status affect the aetiology, bacterial resistance patterns and recommended empiric antibiotic treatment in adult patients with bloodstream infection in Cambodia?". Trop Med Int Health. 18 (4): 485–94. doi:10.1111/tmi.12060. PMID 23294446. 199.Kanai K, Kurata T, Akksilp S, et al. (1992). "A preliminary survey for human immunodeficient virus (HIV) infections in tuberculosis and melioidosis patients in Ubon Ratchathani, Thailand.". Jpn J Med Sci Biol. 45 (5-6): 247–53. doi:10.7883/yoken1952.45.247. PMID 1306871. 200.Chierakul W, Wuthiekanun V, Chaowagul W, et al. (2005). "Short report: disease severity and outcome of melioidosis in HIV coinfected individuals.". Am J Trop Med Hyg. 73 (6): 1165–6. PMID 16354832. 201.Suputtamongkol Y, Hall AJ, Dance DA, et al. (1994). "The epidemiology of melioidosis in Ubon Ratchatani, Northeast Thailand". Int J Epidemiol. 23 (5): 1082–89. doi:10.1093/ije/23.5.1082. PMID 7860160. 202.Currie BJ, Jacups SP (December 2003). "Intensity of Rainfall and Severity of Melioidosis, Australia". Emerging Infect. Dis. 9 (12): 1538–42. doi:10.3201/eid0912.020750. PMC 3034332 . PMID 14720392. 203.Liu Y, Loh JP, Aw LT, Yap EP, Lee MA, Ooi EE (2006). "Rapid molecular typing of Burkholderia pseudomallei, isolated in an outbreak of melioidosis in Singapore in 2004, based on variable-number tandem repeats". Trans Roy Soc Trop Med Hyg. 100 (7): 687–92. doi:10.1016/j.trstmh.2005.08.017. PMID 16343569. 204.Sam IC, Puthucheary SD (2007). "Melioidosis and rainfall in Kuala Lumpur, Malaysia". J Infect. 54 (5): 519–20. doi:10.1016/j.jinf.2006.07.007. PMID 16965821. 205.Baker, Anthony L.; Ezzahir, Jessica; Gardiner, Christopher; Shipton, Warren; Warner, Jeffrey M.; Wooten, R. Mark (23 September 2015). "Environmental Attributes Influencing the Distribution of Burkholderia pseudomallei in Northern Australia". PLOS onE. 10 (9): e0138953. doi:10.1371/journal.pone.0138953. 206.Whitmore, A; Krishnaswami, CS (1912). "An account of the discovery of a hitherto undescribed infectious disease among the population of Rangoon". Indian Med Gazette. 47: 262–267. 207.Strong, Richard P (1944). Stitt's Diagnosis, Prevention and Treatment of Tropical Diseases (7th ed.). Philadelphia: The Blakiston Company. p. 732. 208.Vora SK (February 2002). "Sherlock Holmes and a biological weapon". J R Soc Med. 95 (2): 101–103. doi:10.1258/jrsm.95.2.101. PMC 1279324. PMID 11823558. 209.Whitmore A, Krishnaswami CS (1912). "An account of the discovery of a hitherto undescribed infective disease occurring among the population of Rangoon". Indian Med Gaz. 92: 262–7. 210.Barker A (19 June 2005). "Rise in melioidosis rates in NT". Australian Broadcasting Corporation. Retrieved 2007-06-24. 211.Orellana C (November 2004). "Melioidosis strikes Singapore". Lancet Infect Dis. 4 (11): 655. doi:10.1016/S1473-3099(04)01190-9. PMID 15534940. 212.C S Krishnaswami. "Morphia injectors' septicaemia". Indian Medical Gazette. 52 (1917): 296-299. 213.Melioidosis. Darwin, NT: Australian Centre for Disease Control, January 2012 (http://www.health.nt.gov.au/library/ scripts/objectifyMedia.aspx?file=pdf/43/ 46.pdf&siteID=1&str_title=Melioidosis .pdf). 214.Peacock SJ, Limmathurotsakul D, Lubell Y, et al. Melioidosis vaccines: a systematic review and appraisal of the potential to exploit biodefense vaccines for public health purposes. PLoS Negl Trop Dis 2012;6(1):e1488. 215.Patel N, Conejero L, De Reynal M, Easton A, Bancroft GJ, Titball RW. Development of vaccines against Burkholderia pseudomallei. Front Microbiol 2011;2: 198 216.Currie BJ, Ward L, Cheng AC. The epidemiology and clinical spectrum of melioidosis: 540 cases from the 20 year Darwin prospective study. PLoS Negl Trop Dis 2010;4(11):e900.
|

