|
Tổng quan về virus cúm A/H5N1: vấn đề dịch tễ học, tiến hóa, hình thành genotype và tương đồng kháng nguyên-miễn dịch-vaccine
Cúm gia cầm là bệnh truyền nhiễm cấp tính của gia cầm, do nhóm virus cúm A, thuộc họ Orthomyxoviridae gây ra, có khả năng lan truyền từ động vật sang người. Nhóm virus cúm A có 16 phân type HA (H1 - H16) và 9 phân type NA (N1 - N9) có khả năng tái tổ hợp để tạo nên hàng trăm phân type khác nhau về độc tính và khả năng gây bệnh. H5N1 thể độc lực cao (HPAI) vẫn đang là mối đe dọa cho chăn nuôi và sức khỏe cộng đồng. Từ cuối năm 2003 đến tháng 6/2008, đã có 385 trường hợp mắc cúm A/H5N1, trong đó, 243 trường hợp đã tử vong, chiếm 63,11%, trong đó Việt Nam và Indonesia là hai quốc gia có số người nhiễm và tử vong cao nhất. Không giống như dịch cúm A/H5N1 giai đoạn 1996 - 2002, có thể khống chế bằng cách tiệu diệt và loại trừ loài gia cầm trong vùng dịch để cắt đứt truyền lây, cúm A/H5N1 thể độc lực cao giai đoạn 2003 đến nay, với sự xuất hiện nhiều genotype khác nhau, đặc biệt là genotype Z, lan truyền từ Nam Trung Quốc đến các nơi khác trên thế giới. Đây vẫn là thách thức đối với cộng đồng và cần nghiên cứu ứng dụng các phương pháp khác nhau để khống chế hiệu quả. Tính gây bệnh của A/H5N1 thể độc lực cao không chỉ giới hạn ở chức năng điểm cắt protease của HA và hoạt tính của NA, mà là hiệu ứng của sản phẩm đa gen và khả năng tái tổ hợp tạo virus mới với đặc tính gây bệnh và độc lực khác nhau là vấn đề cần tính đến. Hàng ngàn công trình nghiên cứu về cúm A nói chung và cúm A/H5N1 nói riêng, đặc biệt trong 5 năm gần đây, trong đó có phát triển công nghệ và (các loại) vaccine gây miễn dịch cho gia cầm và chuẩn bị cho đại dịch có thể xảy ra ở người. Về phương diện dịch tễ, tiến hóa, tạo biến chủng, biến đổi kháng nguyên - miễn dịch, tính mẫn cảm và đề kháng với dược liệu, khác với nhiều virus khác ở gia cầm, virus cúm A/H5N1 có xu hướng đột biến nhanh để tạo nên nhiều biến chủng phân chia thành nhiều phân dòng khác nhau và có tính thích ứng phổ rộng đối với loài mắc. Vaccine được phát triển từ nhiều chủng virus cúm A/H5N1 bằng kỹ thuật hiện đại, trong đó có công nghệ di truyền ngược, đặc biệt vaccine từ chủng NIBRG-14 hứa hẹn tiềm năng phòng chống. Trong bài tổng quan này, chúng tôi giới thiệu những đặc điểm cơ bản của vấn đề dịch tễ học, virus học, sinh học phân tử, quá trình tiến hóa, sự hình thành genotype và khái quát mối quan hệ kháng nguyên - miễn dịch - vaccine của cúm A/H5N1 ở Việt Nam và thế giới. Tóm lược những nghiên cứu của các nhà khoa học và tổ chức Việt Nam tại bối cảnh Việt Nam và trên nền virus cúm A/H5N1 của Việt Nam, trong đó có đóng góp của Viện Công nghệ sinh học về gen học/protein học về gen kháng nguyên HA/NA và vaccine thế hệ mới cũng được giới thiêu. Từ khóa:Cúm A/H5N1, dịch tễ học, genotype, Orthomyxoviridae, kháng nguyên - miễn dịch, phân type, thể độc lực cao (HPAI), tiến hóa, vaccine ĐẶC ĐIỂM DỊCH TỄ HỌC BỆNH CÚM GIA CẦM Vài nét về dịch tễ học bệnh cúm gia cầm A/H5N1 Khái quát bệnh cúm gia cầm Cúm gia cầm (Avian Influenza, AI) là bệnh truyền nhiễm cấp tính của gia cầm, do nhóm virus cúm A, thuộc họ Orthomyxoviridae gây ra. Đây là nhóm virus có biên độ chủ rộng, được phân chia thành nhiều phân type khác nhau dựa trên kháng nguyên HA và NA có trên bề mặt capsid của hạt virus (de Wit, Fouchier, 2008). Nhóm virus cúm A có 16 phân type HA (từ H1 đến H16) và 9 phân type NA (từ N1 đến N9), và sự tái tổ hợp (reassortment) giữa các phân type HA và NA, về mặt lý thuyết, sẽ tạo ra nhiều phân type khác nhau về độc tính và khả năng gây bệnh. Mặt khác, virus cúm A có đặc tính quan trọng là dễ dàng đột biến trong gen/hệ gen (đặc biệt ở gen NA và HA), hoặc trao đổi các gen kháng nguyên với nhau, trong quá trình xâm nhiễm và tồn tại lây truyền giữa các loài vật chủ. Họ Orthomyxoviridae đã được phát hiện bao gồm 4 nhóm virus, đó là: nhóm virus cúm A (Influenza A); nhóm virus cúm B (Influenza B); nhóm virus cúm C (Influenza C); và nhóm Thogotovirus. Các nhóm virus khác nhau bởi các kháng nguyên bề mặt capsid, ở virus cúm A và B là Hemagglutinin (HA), ở virus cúm C là Hemagglutinin Esterase Fusion (HEF), và ở Thogotovirus là Glycoprotein (GP) (Murphy, Webster, 1996; Ito et al., 1998). Tình hình dịch bệnh cúm A/H5N1 trên thế giới Cúm A/H5N1 là một virus có độc lực cao, và gây bệnh trên người trong các vụ dịch cúm gà những năm 1996 - 2008, đặc biệt ác liệt là do virus cúm A/H5N1 thể độc lực cao (HPAI, highly pathogenic avian influenza) gây ra kể từ năm 2003 cho đến nay và phát sinh nhiều dưới dòng (sublineage) và nhóm/phân nhóm (clade) có độc lực rất cao (Horimoto, Kawaoka, 2001; Nicholson et al., 2003; Perkins, Swayne, 2003; Ligon, 2005) (Hình 1). Chủng virus cúm A/H5N1 được phát hiện lần đầu tiên gây bệnh dịch trên gà tại Scotland vào năm 1959. Có thể gọi cúm A/H5N1 phân lập năm 1959 tại Scotland là virus cúm A/H5N1 cổ điển (danh pháp: A-Ck-Scotland-(59)(H5N1) (số đăng ký: X07869). Từ đó cho đến nay, H5 và N1 đã có thay đổi lớn xét về cấu trúc thành phần gen và kháng nguyên miễn dịch (Horimoto, Kawaoka, 2006). Sau gần 40 năm không phát hiện, cúm A/H5N1 xuất hiện tại Quảng Đông (1996), và Hồng Kông (1997) với biến đổi sâu sắc, không những gây chết gia cầm mà còn thích ứng và gây chết người bệnh. Có thể coi dòng virus cúm A/H5N1 từ 1996 đến nay là cúm A/H5N1 hiện đại mới xuất hiện (de Jong, Hien, 2006). Đặc biệt, từ 2003 đến nay, virus H5N1 gây ra dịch cúm trên gia cầm tại Hồng Kông, Trung Quốc và lây lan sang hàng chục quốc gia trên thế giới ở châu Á, châu Âu và châu Phi. Cúm A/H5N1 giai đoạn 2003 đến nay, cơ bản về cấu trúc vẫn như trước đó, nhưng xét về độc lực (tính gây bệnh), loài vật chủ nhiễm bệnh, tính kháng nguyên - miễn dịch và mức độ truyền lây có nhiều nét đặc trưng hơn và khác với nhiều biến chủng H5N1 trước đây (Hulse-Post et al., 2005; Subbarao, Luke, 2007; Zhao et al., 2008) (Hình 1). Hình 1. Bản đồ các quốc gia xảy ra dịch cúm A/H5N1 (WHO, tính đến 15/09/2008). Phần bôi đậm là vùngdịch cúm xảy ra trên gia cầm; phần bôi nhạt là vùng dịch cúm chỉ xảy ra trên chim hoang dã. Bảng 1. Tổng số trường hợp nhiễm cúm gia cầm A/H5N1 ở người báo cáo cho WHO từ tháng 12/2003 đến 19/6/2008. Quốc gia | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | Tổng số | | Mắc | Chết | Mắc | Chết | Mắc | Chết | Mắc | Chết | Mắc | Chết | Mắc | Chết | Mắc | Chết | Azerbaijan | 0 | 0 | 0 | 0 | 0 | 0 | 8 | 5 | 0 | 0 | 0 | 0 | 8 | 5 | Bangladesh | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | Cambodia | 0 | 0 | 0 | 0 | 4 | 4 | 2 | 2 | 1 | 1 | 0 | 0 | 7 | 7 | Trung Quốc | 1 | 1 | 0 | 0 | 8 | 5 | 13 | 8 | 5 | 3 | 3 | 3 | 30 | 20 | Djibouti | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | Ai Cập | 0 | 0 | 0 | 0 | 0 | 0 | 18 | 10 | 25 | 9 | 7 | 3 | 50 | 22 | Indonesia | 0 | 0 | 0 | 0 | 20 | 13 | 55 | 45 | 42 | 37 | 18 | 15 | 135 | 110 | Irak | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 2 | 0 | 0 | 0 | 0 | 3 | 2 | Lào | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 2 | 0 | 0 | 2 | 2 | Myanmar | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | Nigeria | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 1 | 1 | Pakistan | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 1 | 0 | 0 | 3 | 1 | Thái Lan | 0 | 0 | 17 | 12 | 5 | 2 | 3 | 3 | 0 | 0 | 0 | 0 | 25 | 17 | Thổ Nhĩ Kỳ | 0 | 0 | 0 | 0 | 0 | 0 | 12 | 4 | 0 | 0 | 0 | 0 | 12 | 4 | Việt Nam | 3 | 3 | 29 | 20 | 61 | 19 | 0 | 0 | 8 | 5 | 5 | 5 | 106 | 52 | Tổng | 4 | 4 | 46 | 32 | 98 | 43 | 115 | 79 | 88 | 59 | 34 | 26 | 385 | 243 |
Ghi chú: Số ca mắc bệnh bao gồm cả các ca tử vong. WHO chỉ ghi nhận những ca được xác nhận bằng xét nghiệm và được báo cáo chính thức. Nguồn: Tổ chức Y tế thế giới - WHO (tính đến tháng 6/2008). Từ cuối 2005, cúm A/H5N1, chủ yếu là các chủng virus thuộc phân dòng Thanh Hải (nguồn gốc vùng Bắc Trung Quốc) bắt đầu lan sang một số nước vùng Trung Á, trong đó có Nga, rồi tràn ngập Đông Âu và xâm nhập vào các nước vùng Tiểu Á, bao gồm Thổ Nhĩ Kỳ, các nước Bắc- Trung Phi, đặc biệt Ai Cập và Nigeria là các nước chịu thiệt hại nhiều nhất (Salzberg, 2007). Nhằm ngăn chặn dịch bệnh lây lan, trong hơn mười năm qua, trên thế giới đã có hàng trăm triệu gia cầm đã bị tiêu hủy, gây thiệt hại nặng nề cho ngành chăn nuôi và kinh tế. Đặc biệt, số người nhiễm và tử vong do virus cúm A/H5N1, mỗi năm một cao hơn, theo thống kê số người bị nhiễm cúm gia cầm H5N1 báo cáo với Tổ chức Y tế thế giới (WHO), từ năm 2003 đến tháng 6/2008, đã có tới 385 trường hợp mắc cúm A/H5N1, trong đó, 243 trường hợp đã tử vong chiếm tới 63,11%. Việt Nam và Indonesia là các 2 quốc gia có số người nhiễm và tử vong cao nhất do virus cúm A/H5N1 trên thế giới (Bảng 1). Trong số 16 nước có người chết do cúm gia cầm, Inonesia và Việt Nam được WHO xác định là quốc gia “điểm nóng” có thể cúm A/H5N1 có được các điều kiện thuận lợi để tiến hóa thích nghi lây nhiễm và trở thành virus của người. Tình hình dịch bệnh cúm A/H5N1 ở Việt Nam Dịch cúm gia cầm A/H5N1 bùng phát tại Việt Nam vào cuối tháng 12/2003 ở các tỉnh phía Bắc, sau đó đã nhanh chóng lan tới hầu hết các tỉnh/thành trong cả nước chỉ trong một thời gian ngắn. Đây là lần đầu tiên dịch cúm gia cầm A/H5N1 xảy ra tại Việt Nam, có tới hàng chục triệu gia cầm bị tiêu hủy, gây thiệt hại nặng nền tới nền kinh tế quốc dân. Tính đến nay (tháng 10/2008), dịch cúm gia cầm liên tục tái bùng phát hàng năm tại nhiều địa phương trong cả nước, có thể phân chia thành các đợt dịch lớn như sau: - Đợt dịch thứ nhất từ tháng 12/2003 và 30/03/2004, dịch cúm xảy ra ở các tỉnh Hà Tây, Long An và Tiền Giang. Dịch bệnh lây lan rất nhanh, chỉ trong vòng hai tháng đã xuất hiện ở 57/64 thành trong cả nước. Tổng số gà và thủy cầm mắc bệnh, chết và thiêu hủy hơn 43,9 triệu con, chiếm 17% tổng đàn gia cầm. Trong đó, gà chiếm 30,4 triệu con, thuỷ cầm 13,5 triệu con. Ngoài ra, có ít nhất 14,8 triệu chim cút và các loại khác bị chết hoặc thiêu huỷ. Đặc biệt, có 3 người được xác định nhiễm virus cúm A/H5N1 và cả 3 đã tử vong trong đợt dịch này. (http://www.cucthuy.gov.vn). - Đợt dịch thứ 2 từ tháng 4 đến tháng 11/2004: dịch bệnh tái phát tại 17 tỉnh, thời gian cao điểm nhất là trong tháng 7, sau đó giảm dần đến tháng 11/2004 chỉ còn một điểm phát dịch. Tổng số gia cầm tiêu hủy được thống kê trong vụ dịch này là 84.078 con. Trong đó, có gần 56.000 gà; 8.132 vịt; và 19.950 con chim cút. Và đã có tới 27 người mắc bệnh virus cúm A/H5N1, trong đó có 9 ca tử vong (http://www.cucthuy.gov.vn). - Đợt 3 từ tháng 12/2004 cho đến tháng 15/12/2005: dịch cúm gà xảy ra trên 36 tỉnh thành trong cả nước. Số gia cầm bị tiêu hủy được Cục Thú y thống kê là 1,846 triệu con (gồm 470.000 gà, 825.000 thủy cầm và 551.000 chim cút). Vào những tháng cuối năm 2005, dịch cúm gà xảy ra trong tháng 10/2005 lan nhanh trong gần 40 tỉnh thành và giảm dần trong tháng 12/2005 (http://www.cucthuy.gov.vn). - Sau một năm (2006), do áp dụng chương trình tiêm chủng rộng rãi cho các đàn gia cầm trong cả nước, cùng với các biện pháp phòng chống dịch quyết liệt, dịch cúm A/H5N1 không xảy ra ở Việt Nam. Mặc dù vậy, đến 06/12/2006 dịch cúm gia cầm A/H5N1 đã tái bùng phát ở Cà Mau, sau đó lan sang các tỉnh Bạc Liêu, Hậu Giang, Vĩnh Long và Cần Thơ(http://www.cucthuy.gov.vn). - Trong năm 2007, dịch bệnh tái phát tại Hải Dương vào ngày 17/02/2007 và được khống chế sau 1 tháng. Tuy nhiên, đến ngày 01/05/2007 dịch bệnh tiếp tục tái phát tại Nghệ An, sau đó lan sang nhiều tỉnh, thành phố trong cả nước. Theo Báo cáo của Cục Thú y (Bộ Nông nghiệp và Phát triển Nông thôn) đến ngày 10/06/2007 dịch đã xảy ra trên 16 tỉnh, thành phố (Nghệ An, Quảng Ninh, Cần Thơ, Sơn La, Nam Định, Đồng Tháp, Hải Phòng, Bắc Giang, Ninh Bình, Bắc Ninh, Vĩnh Phúc, Hà Nam, Quảng Nam, Hưng Yên, Thái Bình và Phú Thọ), và chỉ được khống chế hoàn toàn vào 8/2007. - Gần đây, dịch bệnh lại tiếp tục tái bùng phát ở một số tỉnh phía Bắc vào tháng 3/2008. Cho đến tháng 6/2008, dịch cúm gia cầm A/H5N1 về cơ bản đã được khống chế trên toàn quốc (http://www.cucthuy.gov.vn). Quan hệ lây nhiễm và biểu hiện bệnh Loài mắc Quần thể chim hoang dã (chủ yếu là vịt trời) và gia cầm (vịt, gà tây, gà, ngan, ngỗng) là các vật chủ tự nhiên của virus cúm A. Do đó, virus cúm A thường không gây bệnh hoặc chỉ gây bệnh nhẹ cho chim và gia cầm. Tuy nhiên, một số biến thể cường độc (H5, H7) xuất hiện gần đây do tái tổ hợp với nhiều gen khác nhau, có thể gây dịch cúm nguy hiểm làm chết hàng loạt cả ở chim và gia cầm (Li et al., 2004; Hulse-Post et al., 2005; Alexander, 2007). Tuy nhiên, virus cúm A đặc biệt là chủng virus A/H5N1 hiện đang lưu hành có thể xâm nhiễm gây bệnh ở các loài động vật có vú khác như hổ, mèo ngựa, lợn và người (Murphy, Webster, 1996; Alexander, 2007). Bệnh lây truyền nhanh chóng từ cơ thể bệnh sang cơ thể khỏe mạnh bằng đường hô hấp thông qua các hạt aerosol có chứa virus trong không khí và/hoặc qua đường tiêu hóa do tiếp xúc trực tiếp với các bề mặt (không khí, đất, nước, phương tiện vận chuyển, dụng cụ chăn nuôi bị ô nhiễm (dịch bài xuất, xác vật bệnh, chất thải) của cơ thể bệnh (Silas et al., 2007; Alexander, 2007). Triệu chứng Thời gian ủ bệnh từ vài giờ đến 21 ngày, có trường hợp kéo dài đến 28 ngày. Gia cầm bệnh sốt cao, chảy nước mắt, đứng tụm một chỗ, lông xù, phù đầu và mắt, da tím tái, chân xuất huyết, chảy nước dãi ở mỏ. Con vật khi sốt cao có biểu hiện không bình thường ở hệ thống tiêu hóa, hô hấp, sinh sản và thần kinh. Triệu chứng chung là giảm hoạt động, giảm tiêu thụ thức ăn, gầy yếu. Trường hợp nặng có biểu hiện ho, khó thở, rối loạn thần kinh, ỉa chảy, một số con có biểu hiện co giật hoặc ở tư thế không bình thường. Những triệu trứng trên có thể xảy ra cùng một lúc hoặc riêng rẽ (Tô Long Thành, 2004; Lê Văn Năm, 2005). Đối với người, sau khi nhiễm, thời gian ủ bệnh từ 1 đến 5 ngày trung bình là khoảng 3 ngày. Lúc đầu bệnh nhân sốt cao 39oC và kéo dài từ 1 đến 3 ngày, bệnh nhân cảm thấy khó chịu, toàn thân ê ẩm, ho, sổ mũi nhức đầu khủng khiếp, có thể tiến tới khó thở rồi nghẹt thở, kèm theo các rối loạn về thính giác và thị giác. Đặc biệt, chủng virus cúm A/H5N1 gây tỉ lệ tử vong rất cao cả ở gia cầm và trên người, có người có thể nhiễm cả đường hô hấp trên và dưới (Claas et al., 1998; Hui, 2008). Trong trường hợp không xảy ra những biến chứng phức tạp, sự gây nhiễm tự giới hạn và bệnh nhân tự phục hồi trong vòng một tuần. Tuy nhiên, nếu trường hợp diễn biến phức tạp, bệnh có thể trở nên trầm trọng thậm chí có thể dẫn đến tử vong, đó là trường hợp bị biến chứng đi kèm viêm phổi do virus hoặc do vi khuẩn hoặc cả hai (Bauer et al., 2006; Gambotto et al., 2008). Bệnh tích Bệnh tích đại thể ở các loài khác nhau nên bệnh tích khác nhau. Đối với gia cầm, bệnh tích thường gặp gồm mào, yếm sưng to, phù quanh mí mắt. Thể nhẹ bệnh tích ở xoang đặc trưng bởi viêm cata, lắng đọng fibrin, có mủ hoặc hình thành casien. Có thể phù ở niêm mạc khí quản với dịch thẩm xuất khác nhau từ thanh dịch đến casein. Viêm xoang bụng cata hoặc fibrin, có thể viêm dính buồng trứng với xoang bụng. Xuất huyết điểm trên bề mặt niêm mạc và tương mạc nội tạng. Xuất huyết hầu hết toàn bộ đường tiêu hóa, đặc biệt thấy rõ ở manh tràng, dạ dày tuyến. Tụy thường sưng to, có những vạch vàng hoặc đỏ sẫm theo chiều dọc. Túi Fabricius ở gà xung huyết và xuất huyết. Bệnh tích này rất giống với bệnh tích của bệnh Newcastle (Lê Văn Năm, 2004). Ở người, virus xâm nhập niêm mạc phế nang phế quản, nhân lên gây hủy hoại biểu mô túi khí, gây xung - xuất huyết và tràn dịch phổi ở bệnh nhân. Mặt khác, virus có khả năng gây nhiễm khí quản, ruột, não, và có thể xuyên qua nhau thai xâm nhập bào thai. Mất cân bằng điều hòa miễn dịch do hiện tượng tăng cytokine không kiềm chế (cytokine storm) thường xảy ra dẫn đến cơ thể bị suy sụp và tử vong (Korteweg, Gu, 2008). Chẩn đoán, điều trị Chẩn đoán Chẩn đoán bệnh cúm gia cầm và bệnh cúm ở người thường chủ yếu dựa vào các dấu hiệu lâm sàng, dịch tễ và các xét nghiệm phát hiện sự hiện diện của virus cúm trong cơ thể bệnh, đó là các phản ứng ngăn ngưng kết hồng cầu (HA, heagglutination test), test chẩn đoán nhanh (Capillia Flu A/B test của hãng Nippon Becton Dickinson), hoặc các chẩn đoán xác định dựa vào các xét nghiệm huyết thanh miễn dịch học và phân lập virus (Nicholson et al., 2003; OIE, 2005). Gần đây, các phương pháp Real-Time PCR và reverse transcription-PCR (RT-PCR), kể cảPCR đa gen (multiplex-PCR), trực tiếp sử dụng nguồn gen của virus cúm A và cúm A/H5N1 từ mẫu bệnh phẩm (tracheal or cloacal swab), cũng được đưa vào ứng dụng, cho phép chẩn đoán xác định và phân biệt sự hiện diện của các chủng virus cúm A gây bệnh, có độ chính xác và tin cậy cao chỉ với một lượng nhỏ mẫu bệnh phẩm (OIE, 2005; Zou et al., 2007; Wu et al., 2008). Phòng chống bệnh bằng sử dụng hóa dược liệu Một số dạng hóa dược đang được dùng trong các thuốc ức chế virus không đặc hiệu tác dụng ngăn cản quá trình giải phóng virus ra khỏi tế bào nhiễm (ức chế NA), hoặc ức chế quá trình thoát vỏ (cởi áo) và bao gói của virus do ức chế kênh vận chuyển protein NP vào nhân tế bào trong quá trình nhân lên của virus trong tế bào nhiễm (Hayden et al., 1999; Basler, 2007). Các chế phẩm chủ yếu là Rimantadine, Amantadine (A/H5N1 đã xuất hiện sự kháng thuốc với hai thuốc này (Arinaminpathy et al., 2008) và Oseltamivir (Tamiflu) hoặc phác đồ hỗn hợp cả hai loại (Ilyushina et al., 2007). Trong đó, Oseltamivir ức chế NA của mọi type virus cúm, được sử dụng uống dự phòng trong vòng 48 h sau tiếp xúc với mầm bệnh, và được sử dụng là thuốc dự trữ chiến lược phòng dịch cúm A/H5N1, tuy nhiên thuốc cũng có một vài tác dụng phụ trên người được ghi nhận như gây rối loạn tâm thần và có thể gây độc sau điều trị liều cao (ACIP, 2000; Hayden et al., 1999; Aoki et al., 2007). ĐẶC ĐIỂM VIRUS HỌC CÚM A PHÂN TYPE H5N1 GÂY BỆNH Ở GIA CẦM Cấu tạo và danh pháp Virus cúm A (còn gọi là virus cúm gia cầm, virus cúm gà) có tên khoa học là Avian Influenza (AI), thuộc họ Orthomyxoviridae trong hệ thống phân loại chung (Basic Taxomomy) (Murphy, Webster, 1996). Các hạt virus cúm A (virion) có hình cầu hoặc hình khối đa diện, đường kính 80 -120 nm, đôi khi cũng có dạng hình sợi, khối lượng phân tử khoảng 250 triệu Da. Phân tích thành phần hóa học một virion có chứa khoảng 0,8 - 1,1% RNA; 70 - 75% là protein; 20 - 24% lipid và 5 - 8% là carbonhydrate (Murphy, 1996). Hạt virus có cấu tạo đơn giản gồm vỏ (capsid), vỏ bọc ngoài (envelope) và lõi là RNA sợi đơn âm - negative single strand (Murphy, Webster, 1996) (Hình 2).  | Hình 2. Ảnh chụp kính hiển vi điện tử (A), mô hình (B), và phức hợp ribonucleoprotein RNP (C) của virus cúm A.
Ghi chú: A: Các dạng hình thái khác nhau của virus cúm A dưới kính hiển vi điện tử;
B: Mô hình cấu tạo hạt virus cúm A
(Hemagglutinin: phân tử kháng nguyên HA, Neuraminidase: phân tử kháng nguyên
NA; PB2, PB1, PA: ba dưới đơn vị phức hợp enzyme polymerase của virus).
C: Cấu trúc của phức hợp ribonucleoprotein RNP
(Nguồn: © Paul Digard, Dept Pathology, University of Cambridge). |
Vỏ virus có chức năng bao bọc và bảo vệ vật chất di truyền RNA của virus, bản chất cấu tạo là màng lipid kép, có nguồn gốc từ màng tế bào nhiễm được đặc hiệu hóa gắn các protein màng của virus. Trên bề mặt có khoảng 500 “gai mấu” nhô ra và phân bố dày đặc, mỗi gai mấu dài khoảng 10 - 14 nm có đường kính 4 - 6 nm, đó là những kháng nguyên bề mặt vỏ virus, bản chất cấu tạo là glycoprotein gồm: HA, NA, MA (matrix) và các dấu ấn khác của virus (Bender et al., 1999; Zhou et al., 2007). Có sự phân bố không đồng đều giữa các phân tử NA và HA (tỉ lệ khoảng 1NA/4HA), đây là hai loại protein kháng nguyên có vai trò quan trọng trong quá trình xâm nhiễm của virus ở tế bào cảm nhiễm (Murphy, Webster, 1996; Wagner et al., 2002). Vật chất di truyền (còn gọi là hệ gen) của virus cúm A là RNA sợi đơn âm (viết tắt là (-) ssRNA), gồm 8 phân đoạn riêng biệt (HA, NA, M, NS, NP, PA, PB1 và PB2) nối với nhau thành một sợi duy nhất bên trong vỏ virus, mã hóa cho 11 protein tương ứng của virus, trong đó phân đoạn M mã hóa cho 2 protein là M1 và M2; phân đoạn NS mã hóa cho 2 protein là NS và NEP, phân đoạn PB1 mã hóa cho 2 protein là PB1 và PB1-F2 (Ito et al., 1998; Conenello et al., 2007) (Hình 2).
Về danh pháp, nhóm virus cúm A được phân chia thành nhiều phân type (subtype), các phân type này được phân biệt bởi sự khác nhau ở các đặc tính kháng nguyên bề mặt (NA và HA), cho đáp ứng miễn dịch khác nhau giữa các chủng virus ở cơ thể bị nhiễm (Murphy, Webster, 1996; Wagner et al., 2002). Có 16 phân type HA và 9 phân type NA đã được phát hiện, sự tổ hợp giữa các phân type này, về lí thuyết, có thể tạo ra hơn 254 biến chủng khác nhau, trừ chủng ban đầu (WHO/OIE/FAO, 2008; Chen et al., 2008). Hiện nay, dữ liệu gen và hệ gen của virus cúm A có thể được tìm thấy trong Ngân hàng gen (GenBank: http://www.ncbi.nlm.nih.gov/ genomes/FLU/FLU.html), tại Mạng lưới chuyên gia cúm gia cầm của Tố chức Nông lương thế giới (FAO) và Tổ chức Thú y thế giới (OIE) (OIE-FAO network of expertise on avian influenza: http://www.offlu.net/); và tại trang web của Trung tâm dữ liệu các gen virus cúm (Influenza Sequence Database, ISD: http://www.flu.lanl.gov/). Tổ chức Y tế thế giới (WHO) đã quy định thống nhất danh pháp theo thứ tự kí hiệu: Tên serotype - Loài động vật bị nhiễm - Vùng địa lí phân lập-Số hiệu đăng kí chủng virus - Thời gian phân lập - Loại hình phân type [HA(H) và NA(N)]; ví dụ: A/Chicken/Vietnam/ HG4/2005(H5N1). Đối với các virus được phân lập trên người bệnh, thì không cần ghi loài mắc trong danh pháp, ví dụ: A/Vietnam/1194/2004(H5N1) (WHO/OIE/FAO, 2008). Độc lực và tính thích ứng vật chủ Độc lực gây bệnh của virus cúm A Tính gây bệnh hay độc lực của virus cúm A được chia làm hai loại: Loại độc lực cao (HPAI - Highly pathogenic avian influenza), và loại độc lực thấp (LPAI - Low pathogenic avian influenza), cả hai loại đều cùng tồn tại trong tự nhiên (Kelly et al., 2008). - HPAI: là loại virus cúm A có khả năng gây tổn thương nhiều cơ quan nội tạng trong cơ thể nhiễm, trên gia cầm chúng thường gây chết 100% số gia cầm bị nhiễm trong vòng 48 h sau nhiễm. Loại này rất nguy hiểm gây lo ngại cho cộng đồng. Virus loại HPAI phát triển tốt trên tế bào phôi gà và tế bào thận chó trong môi trường nuôi cấy không có trypsin (Webster, 1998; Alexander, 2007). - LPAI: là loại virus khi phát triển trong cơ thể nhiễm, có thể gây bệnh cúm nhẹ không có triệu chứng lâm sàng điển hình và không làm chết vật chủ. Đây là loại virus lây truyền rộng rãi và tạo nên các ổ bệnh trong tự nhiên của virus cúm A, loại này có thể trao đổi gen với các chủng virus có độc lực cao đồng nhiễm trên cùng một tế bào, và trở thành loại virus HPAI nguy hiểm (Webster, 1998; Alexander, 2007). Tính thích ứng đa vật chủ của virus cúm A/H5N1 Vật chủ tự nhiên của tất cả các chủng virus cúm A/H5N1 là chim hoang dã (chủ yếu là vịt trời), đây là nguyên nhân lan truyền virus trong tự nhiên rất khó kiểm soát. Virus cúm A có khả năng gia tăng biên độ vật chủ của chúng trong quá trình lây truyền ở tự nhiên (Kashet al., 2006; de Wit, Fouchier, 2008). Nhờ đặc tính luôn thay đổi kháng nguyên trong tự nhiên, virus cúm A có khả năng xâm nhiễm ở nhiều loài vật chủ trung gian khác nhau như gia cầm, một số loài động vật có vú (hải cẩu, cá voi, ngựa, lợn) và cả ở người, tạo nên tính thích ứng lan truyền “nội loài” như gà - gà, hay “ngoại loài” như gà - lợn; gà - lợn - người (Hình 3). Vịt (vịt trời) và một số loài thuỷ cầm khác (ngỗng) luôn luôn là vật chủ tàng trữ nguồn virus gây nhiễm (Webster et al., 2002; Weiss, 2003; Chen et al., 2004; Hulse-Post et al., 2005). Đặc điểm thích ứng vật chủ này là điều kiện thuận lợi cho virus cúm A trao đổi, tái tổ hợp các phân đoạn gen, đặc biệt là các phân đoạn gen kháng nguyên (gen “độc” HA và NA) giữa các chủng, tạo ra một chủng virus cúm mới có khả năng thích ứng xâm nhiễm ở loài vật chủ mới của chúng đặc biệt khi chúng vượt qua được “rào cản loài” dễ dàng thích ứng lây nhiễm gây bệnh từ gia cầm sang người và giữa người với người (Horimoto, Kawaoka, 2001; Hilleman, 2002; Chen et al., 2004). Trong lịch sử các đại dịch cúm ở người, lợn thường là vật chủ trung gian chuyển tiếp giúp cho virus cúm A biến đổi để dễ dàng lây nhiễm sang người gây nên bệnh dịch (Ito et al., 1998; Zhu et al., 2008). Ví dụ: cúm A/H3N2 là kết quả tái tổ hợp tự nhiên của virus cúm A/H2N2 của người và virus chứa gen H3 trong tự nhiên thông qua đồng nhiễm trên lợn, gây nên đại dịch cúm châu Á năm 1968 (Nicholson et al., 2003; Webster, 1998; Horimoto, Kawaoka, 2001). Sức đề kháng Virus cúm A tương đối nhạy cảm với các tác nhân bất hoạt vật lí hay hóa học. Các hạt virus tồn tại thích hợp trong khoảng pH từ 6,5 đến 7,9. Ở pH quá acid hay quá kiềm, khả năng lây nhiễm của virus bị giảm mạnh (Fang et al., 2008). Lớp vỏ ngoài của virus bản chất là lớp lipid kép, có nguồn gốc từ màng tế bào nhiễm, dễ bị phá hủy bởi các dung môi hòa tan lipid, chất tẩy rửa và các chất sát trùng: formaldehyde, phenol, β-propiolacton, sodium hypochloride, acid loãng và hydroxylamine. Virus bị bất hoạt dưới ánh sáng trực tiếp sau 40 giờ, tồn tại được 15 ngày ánh sáng thường, tia tử ngoại bất hoạt được virus nhưng không phá hủy được kháng nguyên của virus. Tuy nhiên, virus cúm A dễ dàng bị tiêu diệt hoàn toàn ở 100oC và ở 60oC/30 phút, tồn tại ít nhất 3 tháng ở nhiệt độ thấp (trong phân gia cầm), và tới hàng năm ở nhiệt độ bảo quản (−70oC). Trong phủ tạng gia cầm (40oC), virus tồn tại 25 - 30 ngày, nhưng chỉ tồn tại 7 - 8 ngày ở nhiệt độ cơ thể người (37oC); trong nước, virus có thể sống tới 4 ngày ở nhiệt độ 30oC (Murphy, Webster, 1996; Webster, 1998). Khả năng gây bệnh của virus cúm A Virus cúm A có tính thích ứng lây nhiễm cao với biểu mô đường hô hấp, gây bệnh chủ yếu ở đường hô hấp, và cũng có thể tác động gây tổn thương nhiều cơ quan khác trong cơ thể của các động vật cảm nhiễm, do đó còn được gọi là virus hướng đa phủ tạng (Webster, 1998; Nicholson et al., 2003; Phạm Ngọc Đính et al., 2004). Khả năng gây bệnh của virus cúm A phụ thuộc vào độc lực và tính thích nghi vật chủ của từng chủng virus. Thông thường chúng không gây bệnh hoặc chỉ gây bệnh nhẹ giới hạn ở đường hô hấp của chim hoang dã và gia cầm nhiễm, nhưng một số chủng cường độc (H5, H7, và H1, H2, H3) có thể gây bệnh nặng ở hầu hết các cơ quan trong cơ thể, gây nên dịch cúm ở gia cầm và ở người, có lẽ do tính thích ứng thụ thể sialic của chúng (Suzuki, 2005; Yamada et al., 2006). Hầu hết các chủng virus cúm A nhân lên rất tốt trong phôi gà sau lần cấy truyền thứ nhất, tuy nhiên các chủng cường độc phân type H5, H7 gây chết phôi gà ngay sau vài giờ, cả khi hàm lượng virus rất thấp chưa được nhân lên nhiều, và có thể gây bệnh cúm thực nghiệm trên chuột lang, chuột Hamster, chồn đất (Horimoto, Kawaoka, 1995; de Wit, Fouchier, 2008). Sau khi bị nhiễm virus cúm A, cơ thể vật chủ sinh ra đáp ứng miễn dịch chống lại virus bảo vệ cơ thể, nhưng đáp ứng miễn dịch này có thể không có tác dụng bảo vệ hoàn toàn cho những lần nhiễm sau, do virus cúm A luôn có sự biến đổi kháng nguyên của nó trong quá trình lưu hành ở tự nhiên, và không có đáp ứng miễn dịch chéo giữa các chủng virus cúm A (Webster, 1998). Do đó, khi xuất hiện những biến chủng virus cúm A có đặc tính kháng nguyên khác với các chủng virus trước đó, cơ thể nhiễm sẽ không hoặc ít có đáp ứng miễn dịch bảo hộ thích ứng với chủng virus cúm mới. Đây là nguyên nhân làm cho gia cầm và con người thường bị mắc bệnh cúm nhiều lần trong năm, và các đợt dịch cúm xảy ra về sau thường nặng nề hơn và có thể gây nên đại dịch cúm mới (Doherty et al., 2005). Khả năng gây bệnh của biến chủng virus cúm mới giảm hoặc biến mất, khi cơ thể có được đáp ứng miễn dịch đặc hiệu với biến chủng đó và chúng trở nên thích nghi lây nhiễm ở loài vật chủ mới (Weiss, 2003), ví dụ: virus A/H1N1, A/H2N2, A/H3N2 là nguyên nhân của các đại dịch cúm trên người trước đây và đã thích nghi lây nhiễm ở người (Ito et al., 1998). Tuy nhiên, các chủng này vẫn thường gây ra các vụ dịch cúm tản phát hàng năm ở người, do khả năng biến đổi kháng nguyên của chúng (Hilleman, 2002). Đây cũng chính là nguồn virus trao đổi gen với các chủng virus cúm đang lưu hành ở gia cầm, để thích ứng lây nhiễm gây bệnh cho nhiều loài khác ngay cả trên người (Webster, 1998; Weiss, 2003; Weber, Stilianakis, 2007; Chen et al., 2008). 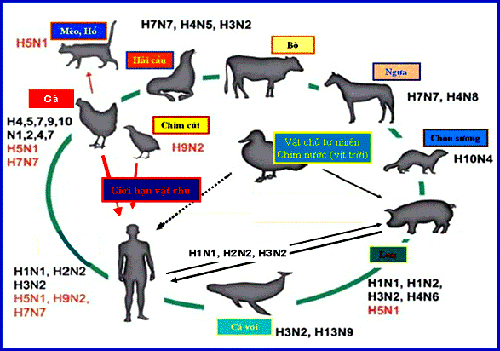 | Hình 3. Mối quan hệ lây nhiễm và thích ứng các loài vật chủ của virus cúm A. |
Cơ chế xâm nhiễm gây bệnh của virus cúm A trong tế bào vật chủ
Virus cúm A/H5N1 kí sinh nội bào bắt buộc, quá trình xâm nhiễm và nhân lên của virus xảy ra chủ yếu ở các tế bào biểu mô đường hô hấp, đường tiêu hóa của cơ thể nhiễm (Murphy, Webster, 1996; Nicholson et al., 2003), có những nét đặc trưng như sau: - Quá trình xâm nhiễm của virus cúm A được mở đầu bằng sự kết hợp của HA và thụ thể thích ứng của nó trên bề mặt các tế bào này, và cuối cùng là giải phóng hệ gen của virus vào trong bào tương của tế bào nhiễm (Hình 4). - Quá trình nhân lên của RNA virus cúm A chỉ xảy ra trong nhân của tế bào, đây là đặc điểm khác biệt so với các virus khác (quá trình này xảy ra trong nguyên sinh chất), và cuối cùng là giải phóng các hạt virus ra khỏi tế bào nhiễm nhờ vai trò của enzyme neuraminidase. Thời gian một chu trình xâm nhiễm và giải phóng các hạt virus mới của virus cúm chỉ khoảng vài giờ (trung bình 6 h). Sự tạo thành các hạt virus mới không phá tan tế bào nhiễm, nhưng các tế bào này bị rối loạn hệ thống tổng hợp các đại phân tử, và rơi vào quá trình chết theo chương trình (apoptosis) làm tổn thương mô của cơ thể vật chủ (Webster, 1998; Uiprasertkul et al., 2007). - Sau khi được giải phóng vào trong bào tương tế bào nhiễm, hệ gen của virus sử dụng bộ máy sinh học của tế bào tổng hợp các protein của virus và các RNA vận chuyển phụ thuộc RNA (RNA-dependent RNA transcription). Phức hợp protein – RNA của virus được vận chuyển vào trong nhân tế bào (Basler, 2007). - Trong nhân tế bào các RNA hệ gen của virus tổng hợp nên các sợi dương từ khuôn là sợi âm của hệ gen virus, từ các sợi dương này chúng tổng hợp nên RNA hệ gen của virus mới nhờ RNA-polymerase. Các sợi này không được Adenine hóa (gắn thêm các Adenine - gắn mũ) ở đầu 5’- và 3’-, chúng kết hợp với nucleoprotein (NP) tạo thành phức hợp ribonucleoprotein (RNP) hoàn chỉnh và được vận chuyển ra bào tương tế bào. Đồng thời, các RNA thông tin của virus cũng sao chép nhờ hệ thống enzyme ở từng phân đoạn gen của virus, và được enzyme PB2 gắn thêm 10 - 12 nucleotide Adenin ở đầu 5’-, sau đó được vận chuyển ra bào tương và dịch mã tại lưới nội bào có hạt để tổng hợp nên các protein của virus (Hình 4). - Các phân tử NA và HA của virus sau khi tổng hợp được vận chuyển gắn lên mặt ngoài của màng tế bào nhiễm nhờ bộ máy Golgi, gọi là hiện tượng “nảy chồi” của virus. NP sau khi tổng hợp được vận chuyển trở lại nhân tế bào để kết hợp với RNA thành RNP của virus. Sau cùng các RNP của virus được hợp nhất với vùng “nảy chồi”, tạo thành các “chồi” virus gắn chặt vào màng tế bào chủ bởi liên kết giữa HA với thụ thể chứa sialic acid. Các NA phân cắt các liên kết này và giải phóng các hạt virus trưởng thành tiếp tục xâm nhiễm các tế bào khác (Murphy, Webster, 1996; Nayak et al., 2004).  | Hình 4.
Mô hình cơ chế xâm nhiễm và nhân lên của virus cúm A ở tế bào chủ. |
ĐẶC ĐIỂM SINH HỌC PHÂN TỬ CỦA VIRUS CÚM A/H5N1 Đặc điểm chung Hệ gen virus cúm A là RNA sợi đơn âm (-)ssRNA, bao gồm 8 phân đoạn gen riêng biệt mang tên từ 1-8 theo thứ tự giảm dần của kích thước phân tử (hay được gọi theo tên protein mà chúng mã hóa tổng hợp), mã hóa cho 11 protein khác nhau của virus gồm: HA, NA, M (M1 và M2), NP, NS (NS1 và NS2), PA, PB1, PB1-F2 và PB2 (Murphy, Webster, 1996; Luong, Palese, 1992; Rabadan et al., 2006) (Hình 2B). Mỗi phân đoạn RNA của virus cúm A có cấu trúc xoắn bậc 2 α đối xứng dài 50 - 100 nm, đường kính 9 - 10 nm, được bao bọc bởi nucleoprotein (NP) - bản chất là lipoprotein, tạo thành cấu trúc ribonucleoprotein (RNP). Mỗi RNP kết hợp với 3 protein enzyme polymerase (PA, PB1 và PB2) chịu trách nhiệm trong quá trình phiên mã và sao chép RNA của virus (Hình 2C). Các phân đoạn của hệ gen virus cúm A nối với nhau bằng các cầu nối peptide tạo nên vòm (loop) tại giới hạn cuối của mỗi phân đoạn, và tạo thành một sợi RNA duy nhất có tổng độ dài từ 10.000 - 15.000 bp (tuỳ theo từng chủng virus cúm A), chứa đựng khoảng 13,5 kilobase thông tin di truyền và có cấu trúc xoắn α (α-helix) bên trong vỏ virus. Hai đầu 5’- và 3’- sợi RNA hệ gen virus có gắn thêm chuỗi nucleotide có tính bảo tồn cao giữa các phân type là: 5’-AGUAGAACAAGG… và 3’- UCG(U/C)UUUCGU CC (Luong, Palese, 1992; Murphy, Webster, 1996). Các phân đoạn gen của virus cúm A/H5N1 Các phân đoạn 1, 2 và 3 là những phân đoạn mã hóa tổng hợp các enzyme trong phức hợp polymerase (RNA transcriptase) của virus, có độ dài ổn định và có tính bảo tồn cao, bao gồm: - Phân đoạn 1 (gen PB2) có kích thước 2431 bp, mã hóa tổng hợp protein enzyme PB2, là tiểu đơn vị thành phần trong phức hợp enzyme polymerase của virus, chịu trách nhiệm khởi đầu phiên mã RNA virus. Protein PB2 có khối lượng phân tử theo tính toán khoảng 84.103 Da (trên thực tế là 87.103 Da) (Murphy, Webster, 1996). Tính thích nghi nhiệt độ cơ thể loài vật chủ được cho là có liên quan đến vị trí amino acid 627 ở protein PB2 (ở virus cúm gia cầm vị trí này là Glu - thích ứng nhiệt độ cơ thể gia cầm khoảng 40oC, còn ở virus thích nghi trên người là Lys - thích ứng nhiệt độ cơ thể người khoảng 37oC) (Subbarao, 1993; Wasilenko et al., 2008). - Phân đoạn 2 (gen PB1) cũng có kích thước 2431 bp, mã hóa tổng hợp enzyme PB1 - tiểu đơn vị xúc tác của phức hợp enzym polymerase trong quá trình tổng hợp RNA virus, chịu trách nhiệm gắn mũ RNA (Murphy, Webster, 1996). Gần đây, đã có phát hiện thêm một protein (PB1-F2) được mã hóa bởi một khung đọc mở khác của PB1, có vai trò gây ra hiện tượng apoptosis (hiện tượng tế bào chết theo chương trình) (Uiprasertkul et al., 2007). - Phân đoạn 3 (gen PA) có kích thước 2233 bp, là phân đoạn gen bảo tồn cao, mã hóa tổng hợp protein enzyme PA có khối lượng phân tử theo tính toán khoảng 83.103 Da (trên thực tế là 96.103 Da). PA là một tiểu đơn vị của polymerase chịu trách nhiệm kéo dài sự phiên mã RNA trong quá trình tổng hợp RNA của virus (Luong, Palese, 1992). Các phân đoạn 4 và 6 mã hóa cho các protein (HA và NA) bề mặt capsid của virus, có tính kháng nguyên đặc trưng theo từng chủng virus cúm A, bao gồm: - Phân đoạn 4 (gen HA) có độ dài thay đổi tuỳ theo từng chủng virus cúm A (ở A/H1N1 là 1778 bp, ở H9N1 là 1714 bp, ở H5N1 là khoảng 1704 - 1707 bp). Đây là gen chịu trách nhiệm mã hóa tổng hợp protein HA - kháng nguyên bề mặt virus cúm, gồm hai tiểu phần là HA1 và HA2. Vùng nối giữa HA1 và HA2 gồm một số amino acid mang tính kiềm được mã hóa bởi một chuỗi oligonucleotide, đó là điểm cắt của enzym protease, và đây là vùng quyết định độc lực của virus (Bosch et al., 1979; Gambotto et al., 2008). Protein HA có khối lượng phân tử khoảng 63.103 Da (nếu không được glycosyl hóa) và 77.103 Da (nếu được glycosyl hóa, trong đó HA1 là 48.103 Da và HA2 là 29.103 Da) (Luong, Palese, 1992; Keawcharoen et al., 2005). - Phân đoạn 6 (gen NA) là một gen kháng nguyên của virus, có chiều dài thay đổi theo từng chủng virus cúm A (ở A/H6N2 là 1413 bp, ở A/H5N1 thay đổi khoảng từ 1350 - 1410 bp). (Nguyễn Thị Bích Nga, 2006). Đây là gen mã hóa tổng hợp protein NA, kháng nguyên bề mặt capsid của virus, có khối lượng phân tử theo tính toán khoảng 50.103 Da (trên thực tế là 50 - 60.103 Da). Các nghiên cứu phân tử gen NA của virus cúm cho thấy phần đầu 5’- của gen này (hay phần tận cùng N của polypeptide NA) có tính biến đổi cao và phức tạp giữa các chủng virus cúm A, sự thay đổi này liên quan đến quá trình thích ứng và gây bệnh của virus cúm trên nhiều đối tượng vật chủ khác nhau (Castrucci, Kawaoka, 1993; Baigent, McCauley, 2001; Wagner et al., 2002). Đặc trưng biến đổi của gen NA trong virus cúm A là hiện tượng đột biến trượt-xóa một đoạn gen là 57 nucleotide, rồi sau đó là 60 nucleotide, làm cho độ dài vốn có trước đây của NA(N1) là 1410 bp còn 1350 bp (Castrucci, Kawaoka, 1993; Lê Thanh Hòa, 2006; Keawcharoen et al., 2005). Các phân đoạn gen M, NP và NS mã hóa tổng hợp các protein chức năng khác nhau của virus, có độ dài tương đối ổn định giữa các chủng virus cúm A, bao gồm: - Phân đoạn 5 (gen NP) kích thước khoảng 1556 bp, mã hóa tổng hợp nucleoprotein (NP) - thành phần của phức hệ phiên mã, chịu trách nhiệm vận chuyển RNA giữa nhân và bào tương tế bào chủ. NP là một protein được glycosyl hóa, có đặc tính kháng nguyên biểu hiện theo nhóm virus, tồn tại trong các hạt virus ở dạng kết hợp với mỗi phân đoạn RNA, có khối lượng phân tử theo tính toán khoảng 56.103 Da (trên thực tế là 50 - 60.103 Da) (Luong, Palese, 1992; Murphy, Webster, 1996;Salzberg, 2007). - Phân đoạn 7 (gen M) có kích thước khoảng 1027 bp, mã hóa cho protein đệm (matrix protein - M) của virus (gồm hai tiểu phần là M1 và M2 được tạo ra bởi những khung đọc mở khác nhau của cùng một phân đoạn RNA), cùng với HA và NA có khoảng 3000 phân tử MP trên bề mặt capsid của virus cúm A, có mối quan hệ tương tác bề mặt với hemagglutinin (Scholtissek et al., 2002). Protein M1 là một protein nền, là thành phần chính của virus có chức năng bao bọc RNA tạo nên phức hợp RNP và tham gia vào quá trình “nảy chồi” của virus (Luong, Palese, 1992; Murphy, Webster, 1996; Basler, 2007). Protein M2 là chuỗi polypeptide bé, có khối lượng phân tử theo tính toán là 11.103 Da (trên thực tế là 15.103 Da), là protein chuyển màng - kênh ion (ion channel) cần thiết cho khả năng lây nhiễm của virus, chịu trách nhiệm “cởi áo” virus trình diện hệ gen ở bào tương tế bào chủ trong quá trình xâm nhiễm trên vật chủ (Scholtissek et al., 2002). - Phân đoạn 8 (gen NS), là gen mã hóa protein không cấu trúc (non structural protein), có độ dài ổn định nhất trong hệ gen của virus cúm A, kích thước khoảng 890 bp, mã hóa tổng hợp hai protein là NS1 và NS2 (còn gọi là NEP, nuclear export protein), có vai trò bảo vệ hệ gen của virus nếu thiếu chúng virus sinh ra sẽ bị thiểu năng (Murphy, Webster, 1996; Sekellick et al., 2000). Độc tính của virus có sự liên quan với gen không cấu trúc (non-structural gen) này được tìm thấy ở biến chủng A/H5N1/97 (Webster, 1998), trong tự nhiên, việc đột biến xóa đi một phần gen có liên quan đến giảm độc lực (Zhu et al., 2008). NS1 có khối lượng phân tử theo tính toán là 27.103 Da (trên thực tế là 25.103 Da), chịu trách nhiệm vận chuyển RNA thông tin của virus từ nhân ra bào tương tế bào nhiễm, và tác động lên các RNA vận chuyển cũng như các quá trình cắt và dịch mã của tế bào chủ. NEP hay NS2, là gen hình thành từ hai đoạn gen (30 bp và 336 bp) mã hóa loại protein có khối lượng phân tử theo tính toán khoảng 14.103 Da (trên thực tế là 12x103 Da), đóng vai trò vận chuyển các RNP của virus ra khỏi nhân tế bào nhiễm để lắp ráp với capsid tạo nên hạt virus mới (Sekellick et al., 2000; Zhu et al., 2008). Như vậy, virus cúm A (cụ thể: cúm A/H5N1) có hệ gen được cấu trúc từ 8 phân đoạn riêng biệt và không có gen mã hóa enzyme sửa chữa RNA, tạo điều kiện thuận lợi cho sự xuất hiện các đột biến điểm trong các phân đoạn gen/hệ gen qua quá trình sao chép nhân lên của virus, hoặc trao đổi các phân đoạn gen giữa các chủng virus cúm đồng nhiễm trên cùng một tế bào, rất có thể dẫn đến thay đổi đặc tính kháng nguyên tạo nên các chủng virus cúm A mới (Suarez, Schultz-Cherry, 2000; Doherty et al., 2006). ĐẶC ĐIỂM TIẾN HÓA VÀ HÌNH THÀNH GENOTYPE CỦA VIRUS CÚM A/H5N1 GIAI ĐOẠN 1996 - 2008 Về sự tiến hóa cúm A/H5N1 Năm 1996, H5N1 được phân lập từ ngỗng tại một ổ dịch ở Quảng Đông (Trung Quốc) và chủng này được coi là chủng nguyên thủy tạo nên các dòng virus gây bệnh cúm gia cầm trong 12 năm qua (Xu et al., 1999). Chủng virus nguyên thủy này, lúc đó cung cấp nguồn gen HA(H5) cho tiến trình tái tổ hợp tạo nên các biến chủng gây dịch bệnh trên gia cầm và người ở Hồng Kông năm 1997, và nguồn gen khung khác của virus cúm A/H5N1 Hồng Kông được kiến tạo từ virus cúm A có ở chim cút (Guan et al., 1999). Riêng nguồn gen NA(N1) còn chưa biết được lấy từ đâu, nhưng cấu trúc của gen có hiện tượng xóa đi 57 nucleotide mã hóa cho 19 amino acid, tại vùng đầu N của protein neuraminidase, và đột biến “xóa gen” này của N1 có liên quan đến tính thích ứng của virus cúm từ thuỷ cầm lên gia cầm trên cạn và người (Matrosovich et al., 1999). Đối với gen HA(H5) đột biến giãn nở chuỗi nối giữa HA1 và HA2 mã hóa cho các amino acid kiềm (Arginine và Lysine) có liên quan đến tiến trình tăng cường độc lực, và ở các chủng thuộc dòng Quảng Đông (Guangdong-like sublineage), các amino acid thông thường là -RRRKK- (Claas et al., 1998; Matrosovich et al., 1999). Sau một năm gây bệnh tại Hồng Kông, do toàn bộ đàn gia cầm bị tiêu diệt, virus cúm A/H5N1 nguyên thủy gốc Quảng Đông không còn gia cầm cạn để gây bệnh, người ta tưởng chúng đã biến mất, nhưng thực tế chủng nguyên thủy này vẫn tiếp tục tồn tại trong ngỗng ở vùng Nam Trung Quốc, trở thành nguồn gen tái tổ hợp hình thành biến chủng mới (Cauthen et al., 2000; Webster et al., 2002). Trong các năm 1997 - 2002, nhiều biến chủng virus cúm A/H5N1 mang nhiều đặc tính kháng nguyên khác nhau của phân type H5 được hình thành tạo nên nhóm kháng nguyên (clade) 1 có độc lực cao với gà nhưng thấp đối với vịt, để rồi bị đào thải trong những năm 2001 - 2002 (Guan et al., 2002; Li et al., 2004). Tiếp tục, trong năm 2002 - 2003, gen HA(H5) có những đột biến mới do hậu quả của hiện tượng lệch kháng nguyên (antigenic drift), để rồi tạo nên biến chủng có tính gây bệnh cực kỳ cao, đặc biệt đối với vịt, và lây sang người (Guan et al., 2004; Sturm-Ramirez et al., 2004). Đặc tính thích ứng gây bệnh trên người càng ngày càng cao dần, cùng với độc lực tăng cường đối với đa vật chủ bao gồm vịt, gà, ngan, ngỗng, chim cút, chim hoang dã và người, để rồi hình thành nhiều biến chủng xâm nhập các nước phía Nam châu Á trong đó có Việt Nam, Thái Lan (Guan et al., 2004; Peiris et al., 2004) (Hình 5).  | Hình 5. Phân nhóm tiến hóa (clade) của cúm A/H5N1 bắt nguồn từ chủng nguyên thuỷ
A-Goose-Gd1-1996(H5N1) xuất hiện tại Quảng Đông (Trung Quốc) năm 1996. |
Có thể nói, sau giai đoạn 1997 - 2003, virus cúm A/H5N1 đã đạt đến mức độ hoàn thiện về đặc tính gây bệnh và thích ứng đa vật chủ, trở nên mối nguy cơ gây bệnh rất cao đối với gia cầm và người trong các năm 2004 - 2005 (Li et al., 2004; Smith et al., 2006). Tuy nhiên, xét về di truyền học và tính kháng nguyên, các chủng H5N1 giai đoạn 1997 - 2002 vẫn mang tính đồng nhất kháng nguyên cùng với chủng nguyên thuỷ A/Gs/Gd/1/96 của Quảng Đông (Chen et al., 2004), và bắt đầu phân hóa ở giai đoạn dịch cúm ác liệt xảy ra năm 2003 - 2005 (de Jong, Hien, 2006). Sự xuất hiện của genotype Z với tính gây bệnh ác liệt trong những năm này ở các nước Đông Nam Á là bằng chứng của sự đột biến “lệch kháng nguyên” của cúm A/H5N1 (Li et al., 2004; Wu et al., 2008b). Cuối năm 2005, có nhiều dưới dòng của virus cúm A/H5N1 cùng lúc được hình thành, đó là sự xuất hiện phân dòng Thanh Hải (Qinghai and Qinghai-like sublineage) và phân dòng Phúc Kiến (Fujian and Fujian-like sublineage), tràn ngập châu Á bao gồm Trung Quốc, Hồng Kông, Việt Nam, Indonesia, Thái Lan (Li et al., 2004; Sims et al., 2005; Smith et al., 2006), tràn sang Trung Á, châu Âu và châu Phi có tính gây bệnh cao đối với người (Skeik, Jabr, 2008; Ducatez et al., 2007; Peiris et al., 2007; Zhao et al., 2008). Các chủng thuộc dưới dòng Phúc Kiến có cấu trúc gen NA(N1) không thay đổi nhiều, nhưng gen HA(H5) có motif amino acid ở vùng nối của điểm cắt protease là -RRRK-, giảm mất một Lysine (K) so với các chủng dưới dòng Quảng Đông (Smith et al., 2006), và do vậy kể từ 2006 đến nay, nhiều chủng/dòng virus cúm A/H5N1 cùng tồn tại gây bệnh, trong đó có nước ta (Dung Nguyen et al., 2008). Trong các năm 2006 - 2008, tuy bình diện dịch cúm gia cầm không ác liệt như những năm 2003-2005, nhưng do xuất hiện nhiều chủng A/H5N1 có biến động kháng nguyên và độc lực, vấn đề dịch tễ học cúm A/H5N1 có thể đã trở nên phức tạp hơn (Zhao et al., 2008; Gambotto et al., 2008).
Về sự hình thành genotype Kể từ khi cúm A/H5N1 hiện đại xuất hiện tại Quảng Đông (A/Gs/CN/Gd1/1996(H5N1) (Xu et al., 1999), có tất cả 12 genotype, bao gồm GD, A, B, C, D, E, X(X0-X3), V, Y, W, Z(Z+) và G đã được phát hiện, trong đó các chủng H5N1 của Việt Nam là loại mới biến đổi, hầu hết thuộc genotype Z và G (Nguyễn Tiến Dũng et al., 2004; Dung Nguyen et al., 2008). Từ năm 2002 trở lại đây, những genotype nguyên thủy của dòng Quảng Đông đã không còn tồn tại (đó là các genotype A, C, D, E), nhưng lại tiến hóa xuất hiện 8 genotype của H5N1 (V, W, X1, X2, X3, Y, Z và Z+) (Li et al., 2004; Macken et al., 2006). Các chủng H5N1 phân lập tại Việt Nam trong những năm 2004 - 2006, thuộc dòng Quảng Đông, tập trung chủ yếu là genotype Z, gần đây xuất hiện thêm genotype G, nhưng được phân biệt làm thành 2 nhóm: nhóm N (North) phổ biến ở Bắc Việt Nam và nhóm S (South) phân bố ở miền Nam (Smith et al., 2006; Dung Nguyen et al., 2008). Năm 2007, ngoài các chủng và genotype thuộc phân dòng Quảng Đông gây dịch cúm gia cầm, còn có một phân dòng khác đã được phân lập và xác định bằng sinh học phân tử phân tích gen H5 và N1, đó là dòng Phúc Kiến (Dung Nguyen et al., 2008 ; Lê Thanh Hòa et al., 2008). Tiến hóa chủng/type và dòng tái tổ hợp mới thường định hình và xuất phát từ các tỉnh ở Nam Trung Quốc (Chen et al., 2006; Smith 2006; Wang et al., 2008). Trừ phân dòng Thanh Hải (Qinghai-like sublineage) chưa được phát hiện tại Việt Nam, hai phân dòng Quảng Đông (Guangdong-like sublineage) và Phúc Kiến (Fujian-like sublineage) đã và đang gây dịch cúm gia cầm ở nước ta, làm cho tình hình dịch tễ và phòng chóng có thể trở nên phức tạp trong định hướng đối phó (Dung Nguyen et al., 2008). ĐẶC ĐIỂM KHÁNG NGUYÊN-MIỄN DỊCH Cấu trúc, chức năng của HA và NA Hai protein HA và NA là các protein chính bề mặt capsid (major capsid protein) đặc trưng cho bản chất của từng chủng virus cúm A (Murphy, Webster, 1996; Keawcharoen et al., 2005). Protein HA (Hemagglutinin) Protein hemagglutinin là một glycoprotein thuộc protein màng type I (lectin), có khả năng gây ngưng kết hồng cầu gà trong ống nghiệm (in vitro), kháng thể đặc hiệu với HA có thể phong tỏa sự ngưng kết đó, được gọi là kháng thể ngăn trở ngưng kết hồng cầu (HI- Hemagglutinin Inhibitory antibody). Có 16 phân type HA đã được phát hiện (H1 - H16, phân type H16 mới được tìm thấy ở virus gây bệnh cho Hải Âu đầu đen - Thụy Điển, 1999 Lê Thanh Hòa, 2006)), ba phân type (H1, H2 và H3) thích ứng lây nhiễm gây bệnh ở người liên quan đến các đại dịch cúm trong lịch sử (Murphy, Webster, 1996). Có khoảng 400 phân tử HA trên bề mặt capsid của một virus, có vai trò quan trọng trong quá trình nhận diện virus và khởi động quá trình xâm nhiễm của virus vào tế bào chủ (Bender et al., 2001; Wagner et al., 2002). Phân tử HA có dạng hình trụ, dài khoảng 130 ăngstron (Å), cấu tạo gồm 3 đơn phân (trimer), mỗi đơn phân (monomer) được tạo thành từ hai dưới đơn vị HA1 (36 kDa) và HA2 (27 kDa), liên kết với nhau bởi các cầu nối disulfide (-S-S-). Các đơn phân sau khi tổng hợp đã được glycosyl hóa (glycosylation) và gắn vào mặt ngoài capsid là dưới đơn vị HA2, phần đầu tự do hình chỏm cầu được tạo bởi dưới đơn vị HA1 chứa đựng vị trí gắn với thụ thể thích hợp của HA trên bề mặt màng tế bào đích (Bosch et al., 1979; 1981; Wagner et al., 2002). Sự kết hợp của HA với thụ thể đặc hiệu (glycoprotein chứa sialic acid) trên bề mặt màng tế bào, khởi đầu quá trình xâm nhiễm của virus trên vật chủ giúp cho virus xâm nhập, hòa màng và giải phóng RNA hệ gen thực hiện quá trình nhân lên ở trong tế bào cảm nhiễm. Quá trình kết hợp phụ thuộc vào sự phù hợp cấu hình không gian của thụ thể chứa acid sialic của tế bào đích với vị trí gắn với thụ thể này trên phân tử HA của virus cúm, quyết định sự xâm nhiễm dễ dàng của virus ở các loài vật chủ khác nhau (Webster, 1998; Wagner et al., 2002). Vị trí amino acid 226 (aa226) của dưới đơn vị HA1 được xác định là vị trí quyết định phù hợp gắn HA với thụ thể đặc hiệu của nó, ở hầu hết các chủng virus cúm A lưu hành trong tự nhiên vị trí này là Glycine, thích ứng với thụ thể Gal α-2,3 sialic acid (chứa sialic acid liên kết với nhóm hydroxyl (4-OH) của galactose ở góc quay α-2,3) của tế bào biểu mô đường hô hấp của chim và gia cầm (vật chủ tự nhiên của virus cúm A). Ngoài ra, một số vị trí amino acid khác: Glutamine 222, Glycine 224, hay cấu trúc SGVSS và NGQSGR cũng có sự liên quan chặt chẽ đến khả năng thích ứng với thụ thể chứa sialic acid bề mặt màng tế bào chủ (Keawcharoen et al., 2005). Đặc biệt, một số chủng virus cường độc A/H5Nx; A/H7Nx lưu hành hiện nay có thể xâm nhiễm trên người, khi chúng có tải lượng cao trong đường hô hấp (do tiếp xúc trực tiếp với chất thải hay gia cầm nhiễm bệnh) (Webster, 1998; Bauer et al., 2006; Hui et al., 2008). Trình tự mã hóa chuỗi nối, và thành phần chuỗi nối trên protein HA cũng như các vị trí amino acid liên quan đến khả năng gắn với thụ thể thích ứng, được coi là các chỉ thị phân tử trong nghiên cứu phân tích gen kháng nguyên HA (Keawcharoen et al., 2005). Protein HA còn là kháng nguyên bề mặt quan trọng của virus cúm A, kích thích cơ thể sinh ra đáp ứng miễn dịch dịch thể đặc hiệu với từng type HA, và tham gia vào phản ứng trung hòa virus, được coi là protein vừa quyết định tính kháng nguyên, vừa quyết định độc lực của virus, là đích của bảo vệ miễn dịch học nhằm ngăn chặn sự xâm nhiễm của virus ở cơ thể nhiễm, cơ sở điều chế các vaccine phòng cúm hiện nay (Bosch et al., 1982; Matrosovich et al., 1999; Keawcharoen et al., 2005 ; Horimoto, Kawaoka, 2006). Protein NA (neuraminidase) Protein neurominidase còn gọi là sialidase (mã số quốc tế là E.C 3.2.1.18), là một protein enzyme có bản chất là glycoprotein được gắn trên bề mặt capsid của virus cúm A, mang tính kháng nguyên đặc trưng theo từng phân type NA (Baigent, McCauley, 2001; Wagner et al., 2002). Có 9 phân type (từ N1 đến N9) được phát hiện chủ yếu ở virus cúm gia cầm, hai phân type N1 và N2 được tìm thấy ở virus cúm người liên quan đến các đại dịch cúm trong lịch sử (Webster, 1998). Có khoảng 100 phân tử NA xen giữa các phân tử HA trên bề mặt capsid hạt virus. Phân tử NA có dạng nút lồi hình nấm, đầu tự do (chứa vùng hoạt động) gồm 4 dưới đơn vị giống như hình cầu nằm trên cùng một mặt phẳng, và phần kị nước gắn vào vỏ capsid (Castrucci, Kawaoka, 1993; Wagner et al., 2002). Protein NA có vai trò là một enzyme cắt đứt liên kết giữa gốc sialic acid của màng tế bào nhiễm với phân tử cacbonhydrate của protein HA, giải phóng hạt virus ra khỏi màng tế bào nhiễm, đẩy nhanh sự lây nhiễm của virus trong cơ thể vật chủ, và ngăn cản sự tập hợp của các hạt virus mới trên màng tế bào. Mặt khác, NA tham gia vào phân cắt liên kết này trong giai đoạn “hòa màng”, đẩy nhanh quá trình cởi áo “uncoating” giải phóng hệ gen của virus vào trong bào tương tế bào nhiễm, giúp cho quá trình nhân lên của virus diễn ra nhanh hơn (Wagner et al., 2002). Ngoài ra, NA còn phân cắt các liên kết glycoside, giải phóng neuraminic acid làm tan loãng màng nhầy bề mặt biểu mô đường hô hấp, tạo điều kiện cho virus nhanh chóng tiếp cận tế bào biểu mô và thoát khỏi các chất ức chế không đặc hiệu. Cùng với vai trò của kháng nguyên HA, cả 3 khâu tác động trên của NA đều tham gia làm gia tăng độc lực gây bệnh của virus cúm A ở cơ thể vật chủ. Do đó, NA là đích tác động của các thuốc, hóa dược ức chế virus không đặc hiệu hiện nay, đặc biệt là Oseltamivir (biệt dược là Tamiflu) phong tỏa enzyme này, ngăn cản sự giải phóng hạt virus mới khỏi các tế bào đích, bảo vệ cơ thể (Castrucci, Kawaoka, 1993; Aoki et al., 2007). Bên cạnh đó, NA còn là một kháng nguyên bề mặt của virus, tham gia kích thích hệ thống miễn dịch của cơ thể chủ, sinh ra kháng thể đặc hiệu với kháng nguyên NA của các chủng virus đương nhiễm có tác dụng phong tỏa protein NA (Doherty et al., 2006). Như vậy, kháng nguyên NA cùng với kháng nguyên HA của virus là các đích chủ yếu của cơ chế bảo hộ miễn dịch của cơ thể với virus cúm A, và là cơ sở điều chế các vaccine phòng cúm hiện nay cho người và gia cầm, nhằm ngăn chặn dịch cúm ở gia cầm và hạn chế lây truyền sang người (Suarez, Schultz-Cherry, 2000; Wu et al., 2008b). Các phương thức biến đổi kháng nguyên Có ba phương thức chủ yếu làm biến đổi kháng nguyên ở virus cúm A (Wu et al., 2008b). Hiện tượng lệch kháng nguyên Lệch kháng nguyên (antigenic drift) thực chất là các đột biến điểm xảy ra các phân đoạn gen/hệ gen của virus. Do virus cúm A kí sinh nội bào bắt buộc, không có cơ chế “đọc và sửa bản sao - proof reading” trong quá trình phiên mã và sao chép ở nhân tế bào đích. Sự thiếu hụt enzyme sửa chữa RNA dẫn đến các enzyme sao chép phụ thuộc RNA sẽ có thể “gài” thêm (đột biến giãn nở), làm mất đi hoặc thay thế (đột biến trượt-xóa) (Lê Thanh Hòa et al., 2006) một hay nhiều nucleotide mà không được sửa chữa trong phân tử RNA chuỗi đơn mới của virus (Murphy, Webster, 1996; Conenello et al., 2007). Tuỳ thuộc vị trí xảy ra các đột biến trong bộ ba mã hóa, mà có thể trực tiếp làm thay đổi các amino acid trong trình tự của protein được mã hóa biểu hiện, dẫn đến thay đổi thuộc tính của protein, hoặc được tích lũy trong phân đoạn gen xảy ra đột biến (đột biến điểm). Tần suất xảy ra đột biến điểm rất cao, cứ mỗi 10.000 nucleotide (tương ứng với độ dài của RNA hệ gen của virus cúm A) thì có 1 nucleotide sai khác (Webster, 1998; Rabadan et al., 2006). Như vậy, gần như mỗi hạt virus mới được sinh ra đều chứa đựng một đột biến điểm trong hệ gen của nó, và các đột biến này được tích lũy qua nhiều thế hệ virus sẽ làm xuất hiện một phân type virus mới có những đặc tính kháng nguyên mới có thể bị sai lệch (Hình 6). Hiện tượng này thường xảy ra ở các phân đoạn gen kháng nguyên NA và HA, tạo ra các bộ mã tổng hợp các amino acid mới, hoặc làm thay đổi cấu trúc dẫn đến thay đổi đặc tính của protein đó, hoặc có khả năng glycosyl hóa rất cao trong cấu trúc chuỗi polypeptide kháng nguyên, tạo ra một biến thể virus mới thay đổi độc lực gây bệnh hay đặc tính kháng nguyên mới (Webster, 1998; Macken et al., 2006; Chen et al., 2008). Hiện tượng trộn kháng nguyên Hiện tượng trộn kháng nguyên (còn gọi là trao đổi hay tái tổ hợp) các gen kháng nguyên (antigenic shift) chỉ có ở virus cúm, và rất ít ở một số virus RNA gây bệnh gia cầm khác, cho phép virus có khả năng biến chủng rất cao. Hệ gen gồm 8 phân đoạn gen riêng biệt của virus cúm A được 2 chủng virus cúm A khác nhau khi đồng nhiễm trong một tế bào trao đổi cho nhau, để có thể xảy ra sự hoà trộn (reassort) hoặc trao đổi (swap) các phân đoạn gen của hai chủng virus đó trong quá trình kết hợp lại RNA hệ gen, tạo ra các trạng thái khác nhau của RNA hệ gen của các hạt virus mới từ hai RNA hệ gen của những virus ban đầu. Kết quả là đã tạo ra thế hệ virus mới có các phân đoạn gen kết hợp, và đôi khi giúp cho chúng có khả năng lây nhiễm ở loài vật chủ mới hoặc gia tăng độc lực gây bệnh (Hình 7) (Hilleman, 2002; Mackenet al., 2006; Chen et al., 2008). Hiện tượng glycosyl hóa Glycosyl hóa (glycosylation) là sự gắn kết của một chuỗi carbonhydrate (oligosaccharide) vào với amino acid Asparagine (N) ở một số vị trí nhất định trong chuỗi polypeptide HA hay NA, hay một số polypeptide khác của virus cúm. Thông thường chuỗi oligosaccharide được gắn tại vị trí N-X-S/T (N = Asparagine; X = amino acid bất kì, trừ Proline; S/T = Serine hoặc Threonine) (Baigent, McCauley, 2001). Đây là những vị trí được cho là gắn kết với các kháng thể được cơ thể sinh ra do kích thích của kháng nguyên, nhằm bảo vệ cơ thể nhiễm. Hiện tượng lệch kháng nguyên sinh ra đột biến điểm hình thành bộ mã của Asparagine, tạo tiền đề cho hiện tượng glycosyl hóa xảy ra khi tổng hợp chuỗi polypeptide HA hay NA, làm thay đổi biểu hiện đặc tính kháng nguyên của HA và NA, giúp cho virus thoát khỏi tác động miễn dịch bảo hộ của cơ thể chủ và điều hoà sự nhân lên của virus (Baigent, McCauley, 2001; Phan Văn Chi et al., 2008). Hiện tượng “lệch kháng nguyên” và “glycosyl hóa” xảy ra liên tục theo thời gian, còn hiện tượng “trộn kháng nguyên” có thể xảy ra với tất cả các chủng của virus cúm A, khi đồng nhiễm trong một tế bào ở tất cả các loài vật chủ khác nhau. Đây cũng chính là vấn đề đáng lo ngại của virus cúm A/H5N1 hiện nay, mặc dù virus này chưa có sự thích nghi lây nhiễm dễ dàng ở người, nhưng nó có khả năng gây bệnh được cho người, và rất có thể A/H5N1 tái tổ hợp (vay mượn) gen HA hay NA, hoặc cả hai gen của các chủng virus cúm A đã thích nghi ở người, để tạo ra một biến chủng virus mới thích ứng lây nhiễm dễ dàng ở người, gây ra nguy cơ của một đại dịch cúm mới và đặt ra một định hướng mới trong phòng chống (Hilleman, 2002; Guanet al., 2004; Li et al., 2004; Arinaminpathy et al., 2008; Korteweg, Gu, 2008)  | | Hình 6. Sơ đồ minh họa đột biến điểm của hiện tượng “ kháng nguyên” (antigenic drift) (A) và đột biến
tái tổ hợp của hiện tượng “trộn kháng nguyên” (antigenic shift) ở virus cúm A (B). |
NGHIÊN CỨU PHÁT TRIỂN VACCINE CÚM A/H5N1 TRÊN THẾ GIỚI VÀ TẠI VIỆT NAM Các chủng virus cường độc A/H5N1 sau 1996, qua thời gian tiến hóa, có xu hướng biến đổi nội gen nhằm tăng tính gây bệnh, và thay đổi thành phần nội gen kháng nguyên làm mất tương quan miễn dịch giữa chúng và các chủng vaccine được tạo ra. Do vậy, vấn đề này phải được hết sức chú ý trong chiến lược kiến tạo vaccine, cũng như sử dụng vaccine được tạo ra (Horimoto, Kawaoka, 2006). Trong tự nhiên, “lệch kháng nguyên” và “glycosyl hóa” là các hiện tượng xảy ra liên tục theo thời gian, còn “trộn kháng nguyên” tái tổ hợp subtype Hemagglutinin (HA) và Neuraminidase (NA) thường định kỳ xảy ra giữa các loài mắc nhằm tạo nên các biến thể virus cúm mới mà hệ miễn dịch của cơ thể vật chủ không có khả năng nhận dạng đáp ứng và kịp hình thành miễn dịch. H5N1 sử dụng thụ thể sialic xâm nhập tế bào (Yamada et al., 2006). Hemagglutinin cùng với protein enzyme neuraminidase, được xác định là protein có vai trò kháng nguyên và độc lực, (Scholtissek et al., 2002; Wagner et al., 2002 ; Keawcharoen et al., 2005) và các protein kháng nguyên có nguồn gen từ các chủng H5N1 của Việt Nam, cũng được nghiên cứu sản xuất bằng kỹ thuật tái tổ hợp và sử dụng với các mục đích khác nhau trong đó có thử nghiệm làm kháng nguyên kích thích miễn dịch và chẩn đoán (Nguyễn Tiến Minh et al., 2004; Simmons et al., 2007). Đối với bệnh truyền nhiễm, vaccine được coi là biện pháp có tính chiến lược, nhằm ngăn chặn lây lan, tạo bảo hộ miễn dịch (Subbarao, Luke, 2007). Đối với dịch cúm A/H5N1 ở gia cầm và dự phòng dịch cúm trên người, nghiên cứu phát triển vaccine không những ngăn ngừa làm giảm được bệnh ở gia cầm, mà còn khống chế nguồn truyền lây của loại virus nguy hiểm này sang người (Horimoto, Kawaoka, 2001; OIE, 2005; Subbarao, Luke, 2007). Kháng thể đặc hiệu có thể được cơ thể sinh ra do kích thích của kháng nguyên trong vaccine, và đó là các kháng thể kháng HA, NA, MA và nhiều loại hình khác của virus đương nhiễm, góp phần vô hiệu hóa virus cúm đúng đối tượng khi chúng xâm nhập vào. Có nhiều loại kháng thể, nhưng trước hết chỉ kháng thể kháng HA(H5) có vai trò tiên quyết quan trọng trong quá trình trung hòa virus cho bảo hộ miễn dịch. Các vaccine phòng bệnh hiện nay dựa trên cơ sở hai loại chính: vaccine truyền thống và vaccine thế hệ mới (Subarao, Luke, 2007; Capua, Alexander, 2008). Vaccine truyền thống: bao gồm vaccine vô hoạt đồng chủng và dị chủng. Vaccine vô hoạt đồng chủng (homologous vaccine), đó là các loại vaccine được sản xuất chứa cùng những chủng virus cúm gà giống như chủng gây bệnh trên thực địa (Swayne, Suarez, 2000). Vaccine vô hoạt dị chủng (heterologous vaccine) là vaccine sử dụng các chủng virus có kháng nguyên HA giống chủng virus trên thực địa, nhưng có kháng nguyên NA dị chủng. Vaccine thế hệ mới hay vaccine công nghệ gen: là loại vaccine được sản xuất dựa trên sử dụng kỹ thuật gen loại bỏ các vùng “gen độc” đang được nghiên cứu và đưa vào sử dụng phổ biến, bao gồm: - Vaccine tái tổ hợp có vector đậu gia cầm dẫn truyền: sử dụng virus đậu gia cầm làm vector tái tổ hợp song gen H5 và N1 phòng chống virus type H5N1 và H7N1 (Qiao et al., 2006). Ví dụ, hãng Merial của Pháp sản xuất vaccine TrovacAIV-H5 lấy nguồn gen H5 từ chủng A/Turkey/Ireland/83 (H5N2), sử dụng được cho gia cầm lúc 1 ngày tuổi. - Vaccine dưới nhóm chứa protein kháng nguyên NA, HA tái tổ hợp và tách chiết làm vaccine (Peyre et al., 2008; Prel et al., 2008). - Vaccine tái tổ hợp có vector dẫn truyền: sử dụng adenovirushoặc Newcastle virus hoặc virus đậu chim làm vector dẫn truyền, lắp ghép gen kháng nguyên H5 vào hệ gen của adenovirus, tạo nên virus tái tổ hợp làm vaccine phòng chống virus cúm A/H5N1 (Hoelscheret al., 2006; Gao et al., 2006; Römer-Oberdörfer et al., 2008). - Vaccine DNA: sản phẩm DNA plasmid tái tổ hợp chứa gen HA, NA, NP, M2 đơn lẻ hoặc đa gen (Kodihalli et al., 1999; Keawcharoen et al., 2005). - Vaccine nhược độc virus cúm nhân tạo: đượcsản xuất bằng kỹ thuật di truyền ngược, đó là việc lắp ghép virus cúm nhân tạo chứa đầy đủ hệ gen, trong đó các gen kháng nguyên H5 có vùng "độc" đã được biến đổi bằng kỹ thuật gen (Liu et al., 2003; Tian et al., 2005). Có 3 loại vaccine đã được Tổ chức Y tế thế giới (WHO) công nhận về độ an toàn và khuyến cáo đưa vào chương trình sản xuất vaccine trên thế giới hiện nay, đó là NIBRG-14 (NIBSC), VN/04xPR8-rg (SJCRH) và VNH5N1-PR8/CDC-rg (CDC). Hai chủng cúm A/H5N1 cung cấp nguồn gen H5 và N1 là A/Vietnam/1194/2004(H5N1) hoặc A/Vietnam/1203/2004(H5N1) (Nicolson et al., 2005). Trung Quốc cũng là nước sản xuất nhiều giống virus vaccine chống cúm, ví dụ, Viện Nghiên cứu Thú y Harbin (Cáp - Nhĩ - Tân) đã thành công trong việc tạo giống vaccine vô hoạt nhũ dầu đơn chủng lấy nguồn gen H5 và N2 từ chủng A/Turkey/England/N-28/73(H5N2), loại subtype H5N2 có độc lực yếu; hay giống vaccine vô hoạt nhũ dầu đơn chủng lấy nguồn gen H5 và N1 từ chủng A/Goose/Guangdong/1996(H5N1), loại có độc lực yếu (Tian et al., 2005; Qiao et al., 2006). Các loại vaccine này đã được nhập và sử dụng tại Việt Nam từ năm 2006 cho đến nay. Vaccine thế hệ mới chủng NIBRG-14: Chủng NIBRG-14 là giống virus vaccine nhược độc (attenuated vaccine) thế hệ mới, thuộc loại hình vaccine được xóa gen bằng công nghệ gen (gene-deletion vaccines), được lắp ráp nhân tạo bằng kỹ thuật di truyền ngược (reverse genetics –based technology) và thích ứng nhân lên khi nuôi cấy trên phôi gà (Marsh, Tannock, 2005).Phương pháp di truyền ngược được sử dụng để tạo ra chủng virus nhân tạo nhược độc làm vaccine, cụ thể hệ gen của chủng nhân tạo NIBRG-14 này được tái tổ hợp gen trên cơ sở sử dụng chủng gốc PR8/34 (A/Puerto Rico/8/34/Mount Sinai(H1N1)) cung cấp 6 gen khung là PA, PB1, PB2, NP, MA, NS làm nền, còn các gen kháng nguyên HA(H5) và NA(N1) được lấy từ chủng cúm cường độc gây bệnh phân lập năm 2004 tại Việt Nam (A/Vietnam/1194/2004(H5N1)) (Tian et al., 2005). Bằng thao tác kỹ thuật gen, gen H5 đã bị đột biến làm mất hẳn 4 amino acid RRRL, cùng với một số đột biến điểm ở các bộ mã ở hai đầu của vùng “độc”, làm thay đổi 3 amino acid tại vùng gây độc. Như vậy về mặt miễn dịch học, mặc dù virus được xử lý làm mất độc tính gây bệnh nhưng vẫn giữ nguyên bản chất đặc tính kháng nguyên bề mặt giống hệt như virus cúm A/H5N1 đã lấy mẫu ban đầu, do vậy, có khả năng tạo kháng thể kháng lại kháng nguyên bề mặt loại virus H5N1 gây bệnh trong tự nhiên (Doherty et al., 2006; Peyre et al., 2008). THAY LỜI KẾT LUẬN VÀ ĐỊNH HƯỚNG TƯƠNG LAI Nghiên cứu định type, biến đổi di truyền và gen học tiến hóa của virus cúm A/H5N1 được các cơ quan nghiên cứu của Việt Nam tiến hành ngay từ những tháng đầu tiên xảy ra dịch cúm gia cầm cuối năm 2003. Những chuỗi gen giúp xác định phân type H5, phân type N1 và các gen cấu trúc đã được Viện Công nghệ Sinh học, Viện Pasteur TP Hồ Chí Minh, Viện Vệ sinh dịch tễ trung ương, Viện Thú y giải mã và công bố trên Ngân hàng gen (Le et al., 2005; Le Thanh Hoa et al., 2006; Dung Nguyen et al., 2008). Trên cơ sở phân tích trình tự gen kháng nguyên H5 và N1, các tác giả khẳng định nguồn gốc của virus cúm A gây bệnh trên gia cầm và người tại Việt Nam cùng nhóm với virus H5N1 phân lập tại Trung Quốc (Nguyễn Tiến Dũng et al., 2004; Lê Thanh Hòa et al., 2006; Muramoto et al., 2006). Các biến chủng H5N1 của Hồng Kông, Trung Quốc phân lập những năm 1997 - 2001 và Hàn Quốc, Đài Loan (phân lập năm 2003) đều có nguồn gốc từ chim cút và ngỗng (A/Goose/Guandong/1/96) vùng Quảng Đông (Trung Quốc), đó là các biến chủng thuộc dòng Quảng Đông (Nguyễn Tiến Dũng et al., 2004; Lê Thanh Hòa et al., 2006; Lê Trần Bình et al., 2006). Như vậy, virus cúm gia cầm gây bệnh ở gia cầm và người tại Việt Nam là cúm H5N1 type A thuộc thế hệ mới đã có biến đổi cơ bản về gen H5 và gen N1, nhưng vẫn có cùng nguồn gốc với H5N1 từ vùng địa lý Nam Trung Quốc và Hồng Kông (Nguyễn Tiến Dũng et al., 2004; 2008; Li et al., 2004; Smith et al., 2006). Các chủng phân lập những năm 2004-2006 đã được nghiên cứu khá chi tiết về góc độ gen học và quan hệ phân tử với các chủng trong vùng và thế giới, kết quả khẳng định virus H5N1 vùng Nam và Đông Nam Á thuộc nhóm di truyền VTM (viết tắt: Vietnam-Thailand-Malaysia), có những đặc tính sinh học nhất định khác với các nhóm vùng Trung Quốc và Hồng Kông (Li et al., 2004; Chen et al., 2006; 2008). Năm 2007, xuất hiện thêm biến chủng H5N1 dưới dòng Phúc Kiến tại Việt Nam, đã và đang làm phức tạp thêm vấn đề dịch tễ học và quan hệ kháng nguyên và miễn dịch, do tỷ lệ tương đồng kháng nguyên HA(H5) và NA(N1) thấp so với các chủng phân dòng Quảng Đông, tuy nhiên vẫn còn có khả năng bảo hộ miễn dịch (Nguyễn Mạnh Kiên et al., 2008; Lê Thanh Hòa et al., 2008; Nguyễn Tiến Dũng et al., 2008; Dung Nguyen et al., 2008 ; Le et al., 2008). Nghiên cứu vấn đề gen học kháng nguyên liên quan đến vaccine và miễn dịch, đã được Viện Công nghệ sinh học, Viện Vệ sinh dịch tễ Trung ương, Viện Pasteur TP Hồ Chí Minh, Viện Thú y trung ương tiến hành đó là việc thu thập gen kháng nguyên H5 và N1 từ các chủng phân lập trên gà, vịt, ngan của Việt Nam các năm 2004 - 2008, và so sánh với trình tự chuỗi gen cúm A/H5N1 của các chủng cường độc đương nhiễm và vaccine của Việt Nam và thế giới (Lê Thanh Hòa et al., 2004; Nguyễn Tiến Dũng et al., 2004; 2008; Nguyễn Thị Bích Nga, 2006; Lê Trần Bình et al., 2006; Le Thanh Hoa et al., 2006; Lê Trần Bình, 2007; Dung Nguyen et al., 2008 ; Le et al., 2008). Năm 2007, xuất hiện thêm chủng H5N1 dưới dòng Phúc Kiến (clade 2.3.4) tại Việt Nam, chắc chắn làm phức tạp thêm vấn đề quan hệ kháng nguyên và miễn dịch, do tỷ lệ tương đồng kháng nguyên HA(H5) qua phân tích gen giữa các chủng phân lập tại Nghệ An (Việt Nam), A/Dk/Vietnam/NA114/2007(H5N1) và A/Dk/ Vietnam/NA72/2007(H5N1), thuộc dòng Phúc Kiến) với các chủng H5N1 thuộc phân dòng Quảng Đông, bao gồm một số chủng làm vaccine đang sử dụng, chỉ đạt 94% (Lê Thanh Hòa et al., 2008 ; Nguyễn Mạnh Kiên et al., 2008). Nhận định hỗn hợp virus gây bệnh và phân hóa kháng nguyên của virus cúm A/H5N1 tại Việt Nam cũng đã được xác nhận qua phân tích hàng chục chủng thu nhận từ nhiều vùng khác nhau trong cả nước (Nguyễn Tiến Dũng et al., 2008; Dung Nguyen et al., 2008; Le et al., 2008). Điều này ảnh hưởng đến dịch tễ, chẩn đoán, phòng trừ và quan hệ lây nhiễm trong tự nhiên (Smith et al., 2006b; Alexander, 2007), cũng như vai trò miễn dịch của các chủng cổ điển đang làm vaccine tại Việt Nam và thế giới (vaccine H5N1, chủng gốc: A-Gs-CN-Gd1(96)(H5N1); vaccine H5N2, chủng gốc: A-Turkey-ENG-N28(73)(H5N2); vaccine TrovacAIV-H5, chủng gốc: A-Tk-IRE-1378(83)(H5N8)); vaccine H5N2, chủng gốc: A-Ck-MEX-Hidalgo-232(94)(H5N2)) và vaccine H5N1 thế hệ mới chủng NIBRG-14, sử dụng chủng gốc: A/Vietnam/1194/2004(H5N1) hiện nay đang được Việt Nam nghiên cứu sản xuất (Lê Trần Bình et al., 2006; Lê Trần Bình, 2007; Nguyễn Thị Lan Phương, Lê Văn Hiệp, 2006). Vấn đề chẩn đoán và xây dựng phương pháp phát hiện nhanh và phân biệt cúm A với các tác nhân gây triệu chứng hô hấp khác, cũng như phân biệt các phân type HA và NA đã được các nhà khoa học Việt Nam quan tâm, kết hợp nghiên cứu với các tổ chức thế giới. Phát hiện nhanh H5N1 và các phân type khác bao gồm việc sử dụng kháng nguyên hoặc kháng thể, hoặc sinh học phân tử đã được xây dựng thành phương pháp (Chan et al., 2007; Wu et al., 2008b). Nghiên cứu vaccine và miễn dịch, các nhà khoa học Việt Nam cũng đã có những đóng góp nhất định về tạo chế phẩm kháng nguyên, tạo vaccine di truyền ngược hoặc vector tái tổ hợp trên nền virus cúm A/H5N1 của Việt Nam (Gao et al., 2006; Bạch Thị Như Quỳnh, 2006; Nguyễn Thị Bích Nga, 2006; Lu et al., 2006; Ge et al., 2007). Vềnghiên cứu sản xuất vaccine, Viện Công nghệ sinh học được giao đề tài độc lập cấp Nhà nước “Nghiên cứu xây dựng qui trình sản xuất vaccine cúm A/H5N1 cho gia cầm” và “Đánh giá chất lượng vaccine phòng bệnh cúm A/H5N1 cho gia cầm tại Việt Nam bằng chủng NIBRG-14” trong giai đoạn 2006 - 2008, kết hợp với Viện Thú y, Xí nghiệp thuốc Thú y trung ương (VETVACO), Công ty Thuốc thú y trung ương II (NAVETCO), Trung tâm Kiểm nghiệm thuốc thú y trung ương, thực hiện nghiên cứu có được vaccine sản xuất từ chủng NIBRG-14 (Lê Trần Bình, 2007). Đây là chủng vaccine được tạo ra bằng công nghệ di truyền ngược tại Viện Tiêu chuẩn và Kiểm định sinh học Quốc gia (Vương quốc Anh), thích ứng trên phôi gà 10 ngày tuổi và vaccine tạo ra dưới dạng vô hoạt nhũ dầu. Đề tài được thực hiện trong 3 năm (2006 - 2008), kết quả là đã xây dựng được các quy trình sản xuất giống, sản xuất vaccine, kiểm nghiệm và bảo quản vaccine cúm A/H5N1 và kiểm nghiệm miễn dịch đạt chất lượng bằng phương pháp huyết thanh học và thử thách cường độc (Nguyễn Thị Lan Phương, Lê Văn Hiệp, 2006; Lê Trần Bình, 2007). Ngoài ra, một số đề tài nhà nước khác nghiên cứu dịch tễ học phân tử, chẩn đoán, vector tái tổ hợp dẫn truyền gen kháng nguyên sử dụng adenovirus hoặc LaSoTa virus, chuyển gen vào thực vật cũng được tiến hành (trao đổi riêng: Trương Nam Hải; Trương Văn Dung; Lê Trần Bình; Lê Thanh Hòa; Nguyễn Tiến Dũng và nhiều người khác). Một số nghiên cứu ứng dụng kỹ thuật/công nghệ cao (di truyền ngược, tái tổ hợp vector) sử dụng nguồn gen H5N1 của Việt Nam, công nghệ tái tổ hợp sản xuất chế phẩm kháng nguyên H5 trong thực vật và tế bào, cũng đang được tiến hành tại Viện Công nghệ sinh học, Viện Thú y, Viện Di truyền nông nghiêp và một số cơ sở nghiên cứu khác (Lê Trần Bình, 2007; Lê Thanh Hòa, 2006a; Nguyễn Tiến Dũng et al., 2008). Song song với những nội dung nghiên cứu về cúm gia cầm ở gia cầm, các cơ sở y tế gồm bệnh viện, viện nghiên cứu (Bệnh viện Nhi trung ương, Viện Vệ sinh dịch tễ Trung ương, Viện Pasteur TP Hồ Chí Minh, Viện Vaccine Nha Trang) đều có những triển khai các lĩnh vực nghiên cứu liên quan đến cúm A/H5N1 trên người (Le et al., 2005; 2008; Nguyễn Thị Kim Tiến, 2005; Dinh et al., 2006; Chan et al., 2007; Hatta et al., 2007) Những kết quả nghiên cứu về cúm A/H5N1 ở gia cầm và người trên nền virus cúm A/H5N1 của Việt Nam đã và đang làm sáng tỏ thêm về mối quan hệ tiến triển bệnh học lây nhiễm, dịch tễ học phân tử, phát triển tiến hóa và genotype và kháng nguyên - miễn dịch - vaccine của cúm gia cầm tại Việt Nam. Lời cảm ơn:Chúng tôi cảm ơn Bộ Khoa học và Công nghệ cấp kinh phí cho đề tài độc lập cấp nhà nước về nghiên cứu vaccine cúm A/H5N1 do GS. TS. Lê Trần Bình chủ nhiệm và đề tài Nghị định thư Việt Nam - Thái Lan về sinh học phân tử cúm A/H5N1 do PGS. TS. Lê Thanh Hòa làm chủ nhiệm.
TÀI LIỆU THAM KHẢO
1.Alexander DJ (2007) An overview of the epidemiology of avian influenza. Vaccine 25(30): 5637-44. Review.
2.Aoki FY, Boivin G, Roberts N (2007) Influenza virus susceptibility and resistance to oseltamivir. Antivir Ther 12(4B): 603-616. Review.
3.Arinaminpathy N, McLean AR (2008) Antiviral treatment for the control of pandemic influenza: some logistical constraints. J R Soc Interface 5(22): 545-553.
4.Bạch Thi Như Quỳnh (2006) Nghiên cứu tạo giống từ chủng gốc NIBRG - 14 để phục vụ sản xuất vaccine cúm H5N1. Luận văn Thạc sĩ sinh học, Viện Sinh thái và tài nguyên sinh vật.
5.Baigent SJ, McCauley JW (2001) Glycosylation of haemagglutinin and stalk-length of neuraminidase combine to regulate the growth of avian influenza viruses in tissue culture. Virus Res 79(1-2): 177-185.
6.Basler CF (2007) Influenza viruses: basic biology and potential drug targets. Infect Disord Drug Targets 7(4): 282-93. Review.
7.Bauer TT, Ewig S, Rodloff AC, Müller EE (2006) Acute respiratory distress syndrome and pneumonia: a comprehensive review of clinical data. Clin Infect Dis 43(6): 748-756. Review.
8.Bender C, Hall H, Huang J, Klimov A, Cox N, Hay A, Gregory V, Cameron K, Lim W and Subbarao K (1999) Characterization of the surface proteins of influenza A (H5N1) viruses isolated from humans in 1997 - 1998. Virology 254: 115-123.
9.Bosch FX, Garten W, Klenk HD, Rott R (1981) Proteolytic cleavage of influenza virus hemagglutinins; primary structure of the connecting peptide between HA1 and HA2 determines proteolytic cleavability and pathogenicity of avian influenza viruses. Virology 113: 725-735.
10.Bosch FX, Orlich M, Klenk HD, Root R (1979) The structure of the hemagglutinin: a determinant for the pathgencity of Influenza virus. Virology 95: 197-207.
11.Capua I, Alexander DJ (2008) Ecology, epidemiology and human health implications of avian influenza viruses: why do we need to share genetic data? Zoonoses Public Health 55(1): 2-15. Review.
12.Castrucci MR, Kawaoka Y (1993) Biologic importance of neuraminidase stalk length in influenza A virus. J Virol67: 759-764.
13.Cauthen AN, Swayne DE, Schultz-Cherry S, Perdue ML, Suarez DL (2000) Continued circulation in China of highly pathogenic avian influenza viruses encoding the hemagglutinin gene associated with the 1997 H5N1 outbreak in poultry and humans. J Virol 74: 6592-6599.
14.Chan KH, Lam SY, Puthavathana P, Nguyen TD, Long HT, Pang CM, Chan KM, Cheung CY, Seto WH, Peiris JS (2007) Comparative analytical sensitivities of six rapid influenza A antigen detection test kits for detection of influenza A subtypes H1N1, H3N2 and H5N1. J Clin Virol 38(2): 169-171.
15.Chen H, Deng G, Li Z, Tian G, Li Y, Jiao P (2004) The evolution of H5N1 influenza viruses in ducks in southern China. Proc Natl Acad Sci USA 101: 10452-10457.
16.Chen LM, Davis CT, Zhou H, Cox NJ, Donis RO (2008) Genetic compatibility and virulence of reassortants derived from contemporary avian H5N1 and human H3N2 influenza A viruses. PLoS Pathog 4(5): e1000072.
17.Claas EC, Osterhaus AD, van Beek R, De Jong JC, Rimmelzwaan GF, Senne DA, Krauss S, Shortridge KF, Webster RG (1998) Human influenza A H5N1 virus related to a highly pathogenic avian influenza virus. Lancet 351:472-477.
18.Conenello GM, Zamarin D, Perrone LA, Tumpey T, Palese P (2007) A single mutation in the PB1-F2 of H5N1 (HK/97) and 1918 influenza A viruses contributes to increased virulence. PLoS Pathog 3(10): 1414-1421.
19.de Jong MD, Hien TT (2006) Avian influenza A (H5N1). J Clin Virol 35(1): 2-13. Review.
20.de Wit E, Fouchier RA (2008) Emerging influenza. J Clin Virol 41(1): 1-6. Review.
21.Dinh PN, Long HT, Tien NT, Hien NT, Mai Le TQ, Phong Le H, Tuan le V, Van Tan H, Nguyen NB, Van Tu P, Phuong NT; World Health Organization/Global Outbreak Alert and Response Network Avian Influenza Investigation Team in Vietnam (2006) Risk factors for human infection with avian influenza A H5N1, Vietnam, 2004. Emerg Infect Dis 12(12): 1841-1847.
22.Doherty PC, Turner SJ, Webby RG, Thomas PG (2006) Influenza and the challenge for immunology. Nat Immunol 7(5): 449-55. Review.
23.Ducatez MF, Olinger CM, Owoade AA, Tarnagda Z, Tahita MC, Sow A, DeLandtsheer S, Ammerlaan W, Ouedraogo JB, Osterhaus AD, Fouchier RA, Muller CP (2007)Molecular and antigenic evolution and geographical spread of H5N1 highlypathogenic avian influenza viruses in western Africa.J Gen Virol 88(8): 2297-2306.
24.Dung Nguyen T, Vinh Nguyen T, Vijaykrishna D, Webster RG, Guan Y, MalikPeiris JS, Smith GJ (2008)Multiple sublineages of influenza A virus (H5N1), Vietnam, 2005-2007.Emerg Infect Dis 14(4): 632-636.
25.Fang LQ, de Vlas SJ, Liang S, Looman CW, Gong P, Xu B, Yan L, Yang H, Richardus JH, Cao WC (2008) Environmental factors contributing to the spread of H5N1 avian influenza in mainland China. PLoS onE 3(5): e2268.
26.Gambotto A, Barratt-Boyes SM, de Jong MD, Neumann G, Kawaoka Y (2008)Human infection with highly pathogenic H5N1 influenza virus.Lancet 371(9622): 1464-1475. Review.
27.Gao W, Soloff AC, Lu X, Montecalvo A, Nguyen DC, Matsuoka Y, Robbins PD, Swayne DE, Donis RO, Katz JM, Barratt-Boyes SM, Gambotto A (2006) Protection of mice and poultry from lethal H5N1 avian influenza virus through adenovirus-based immunization. J Virol 80(4): 1959-1964.
28.Ge J, Deng G, Wen Z, Tian G, Wang Y, Shi J (2007) Newcastle disease virus-based live attenuated vaccine completely protects chickens and mice from lethal challenge of homologous and heterologous H5N1 avian influenza viruses. J Virol 81(1): 150-158.
29.Guan Y, Peiris JS, Lipatov AS, Ellis TM, Dyrting KC, Krauss S (2002) Emergence of multiple genotypes of H5N1 avian influenza viruses in Hong Kong SAR. Proc Natl Acad Sci USA 99: 8950-8955.
30.Guan Y, Poon LL, Cheung CY, Ellis TM, Lim W, Lipatov AS (2004) H5N1 influenza: a protean pandemic threat. Proc Natl Acad Sci USA 101: 8156-8161.
31.Hatta M, Hatta Y, Kim JH, Watanabe S, Shinya K, Nguyen T, Lien PS, Le QM, Kawaoka Y (2007) Growth of H5N1 influenza A viruses in the upper respiratory tracts of mice. PLoS Pathog 3(10): 1374-1379.
32.Hilleman M (2002) Realities and enigmas of human viral influenza: pathogenesis, epidemiology and control. Vaccine 20(25-26): 3068-3087.
33.Hoelscher MA, Garg S, Bangari DS, Belser JA, Lu X, Stephenson I, Bright RA, Katz JM, Mittal SK, Sambhara S (2006) Development of adenoviral-vector-based pandemic influenza vaccine against antigenically distinct human H5N1 strains in mice. Lancet 367(9509): 475-481.
34.Horimoto T, Kawaoka Y (2001) Pandemic threat posed by avian influenza A viruses. Clin Microbiol Rev 14(1): 129-149.
35.Horimoto T, Kawaoka Y (2006) Strategies for developing vaccines against H5N1 influenza A viruses. Trends Mol Med 12(11): 506-514. Review.
36.Hui DS (2008) Review of clinical symptoms and spectrum in humans with influenza A/H5N1 infection. Respirology 13 Suppl 1: S10-3. Review.
37.Hulse-Post DJ, Sturm-Ramirez KM, Humberd J, Seiler P, Govorkova EA, Krauss S, Scholtissek C, Puthavathana P, Buranathai C, Nguyen TD, Long HT, Naipospos TS, Chen H, Ellis TM, Guan Y, Peiris JS, Webster RG (2005). Role of domestic ducks in the propagation and biological evolution of highly pathogenic H5N1 influenza viruses in Asia. Proc Natl Acad Sci USA 102(30): 10682-10687.
38.Ilyushina NA, Hoffmann E, Salomon R, Webster RG, Govorkova EA (2007) Amantadine-oseltamivir combination therapy for H5N1 influenza virus infection inmice. Antivir Ther 12(3): 363-70.
39.Ito T, Couceiro JN, Kelm S, Baum LG, Krauss S, Castrucci MR, Donatelli I, Kida H, Paulson JC, Webster RG and Kawaoka Y (1998) Molecular basis for the generation in pigs of influenza A viruses with pandemic potential. J Virol 72: 7367-7373.
40.Kash JC, Goodman AG, Korth MJ, Katze MG (2006) Hijacking of the host-cell response and translational control during influenza virus infection. Virus Res 119(1): 111-120. Review.
41.Keawcharoen J, Amonsin A, Oraveerakul K, Wattanodorn S, Papravasit T, Karnda S, Lekakul K, Pattanarangsan R, Noppornpanth S, Fouchier RA, Osterhaus AD, Payungporn S, Theamboonlers A and Poovorawan Y (2005) Characterization of the hemagglutinin and neuraminidase genes of recent influenza virus isolates from different avian species in Thailand. Acta Virol 49(4): 277-280.
42.Kelly TR, Hawkins MG, Sandrock CE, Boyce WM (2008) A review of highly pathogenic avian influenza in birds, with an emphasis on Asian H5N1 and recommendations for prevention and control. J Avian Med Surg 22(1): 1-16.
43.Kodihalli S, Goto H, Kobasa DL, Krauss S, Kawaoka Y and Webster RG (1999) DNA vaccine encoding hemagglutinin provides protective immunity against H5N1 influenza virus infection in mice. J Virol 73: 2094-2098.
44.Korteweg C, Gu J (2008) Pathology, molecular biology, and pathogenesis of avian influenza A (H5N1) infection in humans. Am J Pathol 172(5): 1155-1170. Review.
45.LêVăn Năm (2004) Bệnh cúm gà. Tạp chí Khoa học Kỹ thuật Thú y 11(1): 81-86.
46.Le QM, Kiso M, Someya K, Sakai YT, Nguyen TH, Nguyen KH, Pham ND, Nguyen HH, Yamada S, Muramoto Y, Horimoto T, Takada A, Goto H, Suzuki T, Suzuki Y, Kawaoka Y (2005) Avian flu: isolation of drug-resistant H5N1 virus. Nature 437(7062): 1108. Erratum in: Nature 438(7069): 754.
47.Le QMT, Wertheim HF, Nguyen HD, Taylor W, Hoang PV, Vuong CD, Nguyen HL (2008) Influenza A H5N1 clade 2.3.4 virus with a different antiviral susceptibility profile replaced clade 1 virus in humans in northern Vietnam. PLoS onE 3(10): e3339.
48.Lê Thanh Hòa (2006a) Chiến lược nghiên cứu ứng dụng virus vector tái tổ hợp trong sản xuất vaccine thế hệ mới. Tạp chí Công nghệ Sinh học 4(4): 397-416. Tổng quan.
49.Lê Thanh Hòa (2006b) Y-sinh học phân tử (quyển 1). Nhà xuất bản Y học, Hà Nội.
50.Le Thanh Hoa, Dinh Duy Khang, Phan Van Chi, Nong Van Hai, Truong Nam Hai, Nguyen Thi Bich Nga and Le Tran Binh (2006) Molecular characterization of the H5 gene for the highly pathogenic A/H5N1 strains isolated in Vietnam during 2004 - 2006 (pp68-71). Proceedings of International Workshop on Biotechnology in Agriculture (20.10.2006). Nong Lam University Ho Chi Minh City.
51.Lê Thanh Hòa, Đinh Duy Kháng, Phan Văn Chi, Nông Văn Hải, Trương Nam Hải, Lê Trần Bình (2004) Virus cúm A của gia cầm và mối quan hệ lây nhiễm động vật sang người. Tạp chí Công nghệ Sinh học 2(1): 1-18.
52.Lê Thanh Hòa, Nguyễn Thị Bích Nga, Lê Trần Bình (2008) So sánh và phân tích đặc tính đột biến trượt-xóa gen NA(N1) theo thời gian tiến hóa của virus cúm A/H5N1 ở các chủng của Việt Nam và thế giới. Tạp chí Công nghệ Sinh học 6(2): 153-159.
53.Lê Thanh Hòa, Nguyễn Thị Bích Nga, Trần Quang Vui, Nguyễn Mạnh Kiên, Nguyễn Xuân Vũ, Đinh Duy Kháng, Lê Trần Bình (2008) Phát hiện biến chủng virus cúm A/H5N1 dòng Phúc Kiến gây bệnh trên gia cầm/người tại Việt Nam. Tập san Hội nghị khoa học toàn quốc lần thứ tư: Hóa sinh và Sinh học phân tử phục vụ nông, sinh, y học và công nghiệp thực phẩm (Hà Nội, 16-17/10/2008).
54.Lê Trần Bình (2007) Báo cáo tổng kết đề tài độc lập cấp nhà nước: “Nghiên cứu xây dựng qui trình sản xuất vaccine cúm A/H5N1 cho gia cầm” (2006 - 2007). Trung tâm Thông tin và Tư liệu Quốc gia và Bộ Khoa học và Công nghệ, Hà Nội.
55.Lê Trần Bình, Lê Thanh Hòa, Đinh Duy Kháng, Phan Văn Chi, Nông Văn Hải, Nguyễn Thị Bích Nga, Trương Nam Hải (2006) Phân tích mối tương đồng kháng nguyên và miễn dịch của virus cúm A, các chủng cường độc đương nhiễm và các chủng vaccine cúm A/H5N1. Tạp chí Công nghệ Sinh học 4(3): 291-296.
56.Li KS, Guan Y, Wang J, Smith GJ, Xu KM, Duan L (16 others) (2004) Genesis of a highly pathogenic and potentially pandemic H5N1 influenza virus in eastern Asia. Nature 430: 209-213.
57.Liu M, Wood JM, Ellis T, Krauss S, Seiler P, Johnson C, Hoffmann E, Humberd J, Hulse D, Zhang Y, Webster RG, Perez DR (2003) Preparation of a standardized, efficacious agricultural H5N3 vaccine by reverse genetics. Virology 314(2): 580-590.
58.Lu X, Edwards LE, Desheva JA, Nguyen DC, Rekstin A, Stephenson I, Szretter K, Cox NJ, Rudenko LG, Klimov A, Katz JM (2006) Cross-protective immunity in mice induced by live-attenuated or inactivated vaccines against highly pathogenic influenza A (H5N1) viruses. Vaccine 24(44-46): 6588-6593.
59.Luong G, Palese P (1992) Genetic analysis of influenza virus. Curr Opinion Gen Develop 2: 77-81.
60.Macken CA, Webby RJ, Bruno WJ (2006) Genotype turnover by reassortment of replication complex genes from avian influenza A virus. J Gen Virol 87(10): 2803-2815.
61.Marsh GA, Tannock GA (2005) The role of reverse genetics in the development of vaccines against respiratory viruses. Expert Opin Biol Ther 5(3): 369-380. Review
62.Matrosovich M, Zhou N, Kawaoka Y, Webster R (1999) The surface glycoproteins of H5 influenza viruses isolated from humans, chickens, and wild aquatic birds have distinguishable properties. J Virol 73: 1146-1155.
63.Muramoto Y, Le TQ, Phuong LS, Nguyen T, Nguyen TH, Sakai-Tagawa Y, Horimoto T, Kida H, Kawaoka Y (2006) Pathogenicity of H5N1 influenza A viruses isolated in Vietnam between late 2003 and 2005. J Vet Med Sci 68(7): 735-737.
64.Murphy BR, Webster RG (1996) Orthomyxoviruses. In Fields BN, Knipe DM, Howley PM, (eds.) Fields Virology, 3rd ed, Lippincott-Raven Publishers, Philadelphia: 1397-1445.
65.Nayak D, Hui E, Barman S (2004) Assembly and budding of influenza virus. Virus Res 106(2): 147-165.
66.Nguyễn Mạnh Kiên, Nguyễn Thị Bích Nga, Lê Thanh Hòa (2008) Đặc điểm gen H5 của virus cúm A/H5N1 thuộc dưới dòng Phúc Kiến (Fujian) gây bệnh trên gia cầm và người tại Việt Nam phân lập năm 2007. Tạp chí Y-Dược học quân sự (đang in).
67.Nguyễn Thị Bích Nga (2006) Phân lập, lưu giữ và nghiên cứu đặc tính phân tử gen HA(H5) và NA(N1) của một số chủng virus cúm A/H5N1 phân lập ở Việt Nam, Luận văn Thạc sĩ Sinh học, Viện Sinh thái và tài nguyên sinh vật.
68.Nguyễn Thị Kim Tiến (2005) Dịch tễ học, virus học bệnh cúm A(H5N1) trên người tại khu vực phía Nam. Tạp chí Y học thực hành 517(8): 46-49.
69.Nguyễn Thị Lan Phương, Lê Văn Hiệp (2006) Nghiên cứu sản xuất vaccine phòng chống cúm A/H5N1 cho người trên phôi gà từ chủng NIBRG-14 tại Viện vaccine và sinh phẩm y tế, Nha trang. Tạp chí Y học dự phòng 5(84): 5-10.
70.Nguyễn Tiến Dũng (2008) Vài nét về virus cúm gia cầm H5N1. Tạp chí Khoa học Kỹ thuật Thú y 14(4): 80-86.
71.Nguyễn Tiến Dũng, Malik Peiris, Robert Webster, Đào Thanh Vân, Bùi Ngọc Anh, Nguyễn Thế Vinh, Kent Inui, Bùi Nghĩa Vượng, Nguyễn Viết Không, Ngô Thanh Long (2004) Nguồn gốc virus cúm gia cầm H5N1 tại Việt Nam năm 2003 - 2004. Tạp chí Khoa học Kỹ thuật Thú y 11(3): 6-14.
72.Nguyễn Tiến Minh, Bạch Thị Như Quỳnh, Nguyễn Thị Ngọc Diệp, Bùi Hoàng Anh, Dương Hồng Quân, Nguyễn Thị Hồng Hạnh, Nguyễn Thị Thu Trang, Nguyễn Thanh Liêm, Nông Văn Hải, Lê Thanh Hoà, Đinh Duy Kháng, Lê Trần Bình (2004) Tách dòng và phân tích trình tự gen mã hóa hemagglutinin (HA) của virus cúm A (H5N1) từ một bệnh nhân. Tạp chí Công nghệ Sinh học 2(3): 279-286.
73.Nicholson KG, Wood JM, Zambon M (2003) Influenza. Lancet 362(93970: 1733-1745.
74.Nicolson C, Major D, Wood JM, Robertson JS (2005)
75.Generation of influenza vaccine viruses on Vero cells by reverse genetics: an H5N1 candidate vaccine strain produced under a quality system. Vaccine 23(22): 2943-2952.
76.OIE - World organisation for animal health (2005) Avian influenza. Manual of diagnostic test and vaccines for terrestrial animals, (http://www.oie.int/ Eng/info_ev/en_AI_avianinfluenza.htm)
77.Peiris JS, de Jong MD, Guan Y (2007) Avian influenza virus (H5N1): a threat to human health. Clin Microbiol Rev 20(2): 243-267. Review.
78.Peiris JS, Yu WC, Leung CW, Cheung CY, Ng WF, Nicholls JM (2004) Re-emergence of fatal human influenza A subtype H5N1 disease. Lancet 363: 617-619.
79.Peyre M, Fusheng G, Desvaux S, Roger F (2008) Avian influenza vaccines: a practical review in relation to their application in the field with a focus on the Asian experience. Epidemiol Infect 14: 1-21.
80.Phan Văn Chi, Lê Thanh Hòa, Đinh Duy Kháng, Nông Văn Hải, Trương Nam Hải, Nguyễn Thị Bích Nga, Quyền Đình Thi, Phạm Việt Cường, Lê Trần Bình (2008) Phân tích đặc tính glycosyl hóa gen kháng nguyên H5 ở các chủng virus cúm A/H5N1 vaccine và cường độc gây bệnh. Tạp chí Công nghệ Sinh học (đã nhận đăng).
81.Prel A, Le Gall-Reculé G, Jestin V (2008) Achievement of avian influenza virus-like particles that could be used as a subunit vaccine against low-pathogenic avian influenza strains in ducks. Avian Pathol 37(5): 513-520.
82.Qiao C, Tian G, Jiang Y, Li Y, Shi J, Yu K, Chen H (2006) Vaccines developed for H5 highly pathogenic avian influenza in China. Ann N Y Acad Sci 1081: 182-192.
83.Rabadan R, Levine AJ, Robins H (2006) Comparison of avian and human influenza A viruses reveals a mutational bias on the viral genomes. J Virol 80(23): 11887-11891
84.Römer-Oberdörfer A, Veits J, Helferich D, Mettenleiter TC (2008)Level of protection of chickens against highly pathogenic H5 avian influenza virus with Newcastle disease virus based live attenuated vector vaccine depends on homology of H5 sequence between vaccine and challenge virus. Vaccine 26(19): 2307-2313.
85.Salzberg SL (2007) Genome Analysis Linking Recent European and African Influenza (H5N1) Viruses. Emerg Infect Dis 13(5): 713-718.
86.Scholtissek C, Stech J, Krauss S, Webster RG (2002)
87.Cooperation between the hemagglutinin of avian viruses and the matrix protein of human influenza A viruses. J Virol 76(4): 1781-1786.
88.Sekellick MJ, Carra SA, Bowman A, Hopkins DA, Marcus PI (2000) Transient resistance of influenza virus to interferon action attributed to random multiple packaging and activity of NS genes. J Interferon Cytokine Res 20(11): 963-970.
89.Silas L, Johnson N, Rexe K (2007) Safety is not negotiable: the importance of occupational health and safety to pandemic planning. Healthc Pap 8(1): 8-16.
90.Simmons CP, Bernasconi NL, Suguitan AL, Mills K, Ward JM, Chau NV, Hien TT, Sallusto F, Ha Do Q, Farrar J, de Jong MD, Lanzavecchia A, Subbarao K (2007) Prophylactic and therapeutic efficacy of human monoclonal antibodies against H5N1 influenza. PLoS Med 4(5): e178.
91.Sims LD, Domenech J, Benigno C, Kahn S, Kamata A, Lubroth J, Martin V, Roeder P (2005) Origin and evolution of highly pathogenic H5N1 avian influenza in Asia. Vet Rec 157(6): 159-164. Review.
92.Skeik N, Jabr FI (2007) Influenza viruses and the evolution of avian influenza virus H5N1. Int J Infect Dis 12(3): 233-238. Review.
93.Smith GJ, Fan XH, Wang J, Li KS, Qin K, Zhang JX, Vijaykrishna D, Cheung CL, Huang K, Rayner JM, Peiris JS, Chen H, Webster RG, Guan Y (2006) Emergence and predominance of an H5N1 influenza variant in China. Proc Natl Acad Sci USA 103(45): 16936-16941.
94.Sturm-Ramirez KM, Ellis T, Bousfield B, Bissett L, Dyrting K, Rehg JE (2004) Reemerging H5N1 influenza viruses in Hong Kong in 2002 are highly pathogenic to ducks. J Virol 78: 4892-4901.
95.Suarez DL, Schultz-Cherry S (2000) Immunology of avian influenza virus: a review. Dev Comp Immunol 24(2-3): 269-283. Review.
96.Subbarao K, Klimov A, Katz J, Regnery H, Lim W, Hall H (1998) Characterization of an avian influenza A (H5N1) virus isolated from a child with a fatal respiratory illness. Science 279: 393-396.
97.Subbarao K, Luke C (2007) H5N1 viruses and vaccines. PLoS Pathog 3(3): e40. Review.
98.Suzuki Y (2005) Sialobiology of influenza: molecular mechanism of host range variation of influenza viruses. Biol Pharm Bull 28(3): 399-408. Review.
99.Swayne DE, Suarez DL (2000) Highly pathogenic avian influenza. Rev Sci Tech Off Int Epiz 20: 463-482.
100.Tian G, Zhang S, Li Y, Bu Z, Liu P, Zhou J, Li C, Shi J, Yu K, Chen H (2005) Protective efficacy in chickens, geese and ducks of an H5N1-inactivated vaccine developed by reverse genetics. Virology 341(1): 153-162.
101.Tô Long Thành (2004) Bệnh cúm loài chim. Tạp chí Khoa học Kỹ thuật Thú y 11(2): 53-58.
102.Uiprasertkul M, Kitphati R, Puthavathana P, Kriwong R, Kongchanagul A, Ungchusak K, Angkasekwinai S, Chokephaibulkit K, Srisook K, Vanprapar N, Auewarakul P (2007) Apoptosis and pathogenesis of avian influenza A (H5N1) virus in humans. Emerg Infect Dis 13(5): 708-712.
103.Wagner R, Matrosovich M, Klenk H (2002) Functional balance between haemagglutinin and neuraminidase in influenza virus infections. Med Virol 12(3): 159-166.
104.Wang J, Vijaykrishna D, Duan L, Bahl J, Zhang JX, Webster RG, Peiris JS, Chen H, Smith GJ, Guan Y (2008) Identification of the progenitors of Indonesian and Vietnamese avian influenza A(H5N1) viruses from southern China. J Virol 82(7): 3405-3414.
105.Wasilenko JL, Lee CW, Sarmento L, Spackman E, Kapczynski DR, Suarez DL, Pantin-Jackwood MJ (2008) NP, PB1, and PB2 viral genes contribute to altered replication of H5N1 avian influenza viruses in chickens. J Virol 82(9): 4544-4553.
106.Weber TP, Stilianakis NI (2007) Ecologic immunology of avian influenza (H5N1) in migratory birds. Emerg Infect Dis 13(8): 1139-1143. Review.
107.Webster RG (1998) Influenza: an emerging disease. Emerg Infect Dis 4: 436-441.
108.Webster RG, Guan Y, Peiris M, Walker D, Krauss S, Zhou NN, Govorkova EA, Ellis TM, Dyrting KC, Sit T, Perez DR, Shortridge KF (2002) Characterization of H5N1 influenza viruses that continue to circulate in geese in southeastern China. J Virol 76(1): 118-126.
109.Weiss RA (2003) Cross-species infections. Curr Top Microbiol Immunol 278: 47-71.
110.WHO/OIE/FAO H5N1 Evolution Working Group (2008) Toward a unified nomenclature system for highly pathogenic avian influenza virus(H5N1).
111.Emerg Infect Dis 14(7): e1.
112.Wu C, Cheng X, He J, Lv X, Wang J, Deng R, Long Q, Wang X (2008a) A multiplex real-time RT-PCR for detection and identification of influenza virus types A and B and subtypes H5 and N1. J Virol Methods 148(1-2): 81-88.
113.Wu WL, Chen Y, Wang P, Song W, Lau SY, Rayner JM, Smith GJ, Webster RG, Peiris JS, Lin T, Xia N, Guan Y, Chen H (2008b) Antigenic profile of avian H5N1 viruses in Asia from 2002 to 2007. J Virol 82(4): 1798-17807.
114.Xu X, Subbarao K, Cox NJ, Guo Y (1999) Genetic characterization of the pathogenic influenza A/Goose/Guangdong/1/96 (H5N1) virus: similarity of its hemagglutinin gene to those of H5N1 viruses from the 1997 outbreaks in Hong Kong. Virology 261: 15-19.
115.Yamada S, Suzuki Y, Suzuki T, Le MQ, Nidom CA, Sakai-Tagawa Y, Muramoto Y, Ito M, Kiso M, Horimoto T, Shinya K, Sawada T, Kiso M, Usui T, Murata T, Lin Y, Hay A, Haire LF, Stevens DJ, Russell RJ, Gamblin SJ, Skehel JJ, Kawaoka Y (2006) Haemagglutinin mutations responsible for the binding of H5N1 influenza A viruses to human-type receptors. Nature 444(7117): 378-382.
116.Zhao ZM, Shortridge KF, Garcia M, Guan Y, Wan XF (2008) Genotypic diversity of H5N1 highly pathogenic avian influenza viruses. J Gen Virol 89(9): 2182-2193.
117.Zhou JJ, Fu J, Fang DY, Yan HJ, Tian J, Zhou JM, Tao JP, Liang Y, Jiang LF (2007) Molecular characterization of the surface glycoprotein genes of an H5N1 influenza virus isolated from a human in Guangdong, China. Arch Virol 152(8): 1515-1521.
118.Zhu Q, Yang H, Chen W, Cao W, Zhong G, Jiao P, Deng G, Yu K, Yang C, Bu Z, Kawaoka Y, Chen H (2008) A naturally occurring deletion in its NS gene contributes to the attenuation of an H5N1 swine influenza virus in chickens. J Virol 82(1): 220-228.
119.Zou S, Han J, Wen L, Liu Y, Cronin K, Lum SH, Gao L, Dong J, Zhang Y, Guo Y, Shu Y (2007) Human influenza A virus (H5N1) detection by a novel multiplex PCR typing method. J Clin Microbiol 45(6): 1889-1892. THE A/H5N1 INFLUENZA VIRUS: INSIGHTS OF EPIDEMIOLOGY, EVOLUTION, GENOTYPE GENERATION AND COMPATIBILITY OF ANTIGENICITY - IMMUNOGENICITY - VACCINE Le Thanh Hoa, Dinh Duy Khang, Phan Văn Chi, Nong Van Hai, Truong Nam Hai, Pham Viet Cuong, Nguyen Thi Bich Nga, Le Tran Binh
Institute of Biotechnology
SUMMARY
Avian influenza is a highly pathogenic and contagious disease caused by influenza A viruses, of which the causative agent belongs to the family Orthomyxoviridae, which can be transmitted from the infected animals to humans. There are 16 subtypes HA (H1 - H16) and 9 subtype NA (N1 - N9) to be known to go through reassortment to generate hundreds of variants of different virulence and pathgenicity. H5N1 highly pathogenic avian influenza (HPAI) has continued to pose a significant threat to both animal and human health. From late 2003 to June 2008, accumulated number of infected human cases is 385 with 243 deaths, presenting 63.11% mortality rate, whereas Vietnam and Indonesia are the two countries of highest casualty. Unlike previous poultry outbreaks of highly pathogenic avian influenza due to H5 occurred from 1996 -2002 that they were controlled by depopulation with or without vaccination, the presently circulating A/H5N1 viruses (from 2003 - present) with formation of different genotypes, particularly genotype Z, have since been spreading from Southern China to other parts of the world. This is still a great threat to public health and defferent measures are needed to be developed to control. The virulence determinants for highly pathogenic avian influenza viruses are not limited to the best characterized virulence factor, the hemagglutinin (HA) cleavage site and the enzymatic activity of neuraminidase (NA), but rather are considered to be multigenic and capable to reassort gene segments for new viruses to emerge with different virulence characteristics, evidently encountered. Tens of thousand papers presenting the research work related to avian influenza A, in general, and to A/H5N1 in particular, ie. in recent 5 years, have been generated of which many come from the development of new technologies and vaccine(s) for immunization of poultry and for preparedness of pandemic possibly to occur in humans. In the view of epidemiology, evolution, genotype formation, antigenic variation to alter immunogenicity, sensitivity and resistance to pharmaceuticals, unlike other avian viruses, A/H5N1 virus tends to mutate in a fast way to generate new variants of new sublineages and tends to search for wider host spectrum to infect. Vaccine(s) from different reference strains of H5N1 have been developed using high-technologies including reverse-genetics, particularly, those which have been based on NIBRG-14 promise a good potentiality in control in future. Here, we review the basic understandings of epidemiological aspects, virology, molecular biology, evolutionary ocurrence, genotype formation, and current strategies for the development of H5N1 influenza vaccines, and possibilities of antigenic-immunogenic-vaccine relationships in Vietnam and worldwide. Summarized research works of the Vietnamese scientists and institutions regarding to research on the H5N1 endemics in Vietnam and on the materials of Vietnam origin including the contribution of the Institute of biotechnology on genomics/proteomics of the gene(s) of HA/NA and new generation vaccines are also introduced.
Keywords:A/H5N1, antigenicity-immunogenicity, epidemiology, evolution, genotype, highly pathogenic avian influenza (HPAI), Orthomyxoviridae, subtype, vaccine
|

