|
Ký sinh trùng sốt rét Plasmodium falciparum kháng thuốc Artemisinine và các giá trị nghiên cứu sinh học phân tử phát hiện đột biến gen K13 Propeller (Phần 2)
Các phương pháp nghiên cứu và đánh giá mức độ kháng thuốc Các kỹ thuật nghiên cứu KSTSR kháng thuốc được nhiều tácgiả trên thế giới xây dựng và áp dụng rộng rãi, trong đó quan trọng phải kể đếnkỹ thuật invivo, invitro và sinh học phân tử như (PCR, Nested PCR và giải trình tự gen). Về nguyên tắc, giám sát đáp ứng KSTSR với thuốc chống SR theo phương pháp in vivo và in vitro cần làm thường xuyên. Trong đó, giám sát in vivo là phương pháp quan trọng nhất trong quyết định phác đồ điều trị, phát triển chính sách thuốc sốt rét thiết yếu quốc gia theo từng giai đoạn. Việc giám sát trên in vitro đánh giá độ nhạy cảm của KSTSR với thuốc sẽ cung cấp những dấu hiệu dự báo sớm kháng thuốc và bổ sung dữ liệu cho thay đổi chiến lược thuốc trên địa bàn. Kỹ thuật nghiên cứu in vivo Với mục đích đánh giá hiệu lực điều trị, xác định hiệu quả thực tế của từng phác đồ thuốc, giám sát đáp ứng với thuốc và xây dựng chính sách thuốc quốc gia, TCYTTG đã đưa ra một số thử nghiệm, kỹ thuật phù hợp và theo sự phát triển các kỹ thuật nghiên cứu: · Thử nghiệm in vivo 7, hay 14 hay 28 ngày để đánh giá hiệu lực thuốc điều trị: + Nhạy (Sensitivity_S): sạch KSTSR thể vô tính máu ngoại vi trong 7 ngày đầu (kể từ ngày uống thuốc) và không tái phát trong 28 ngày tiếp theo; + Kháng độ 1 (Resistance I_RI): KSTSR tái phát trong phạm vi 3 tuần sau; + Kháng độ 2 (RII): mật độ KSTSR ngày thứ 7 (D7) giảm so với ngàyD0; + Kháng độ 3 (RIII): mật độ KSTSR không giảm mà tăng so với ngày D0. · Đánh giá đáp ứng điều trị theo 3 loại: thất bại điều trị sớm, thất bại điều trịmuộn và đáp ứng lâm sàng đầy đủ (WHO, 2005). -Thất bại điều trị sớm (Early Treatment Failure_ETF) + Phát triển các dấu chứng nguy hiểm hoặc SR nặng vào ngày D1,D2hoặc D3 kèm theo có KSTSR trong máu; + Mật độ KSTSR trong máu vào ngày D2 cao hơn ngày D0 khôngtính đến hay bất luận nhiệt độ cơ thể như thế nào; + Có KSTSR trong máu vào ngày D3 và nhiệt độ nách ≥ 37,5°C; + Mật độ KSTSR trong máu vào ngày D3 ≥ 25% mật độ ngày D0
- Thất bại điều trị muộn (Late Treatment Failure_LTF), gồm có: + Thất bại lâm sàng muộn (Late Clinical Failure_LCF) gồm có (i) Phát triển các dấu hiệu nguy hiễm hoặc sốt rét ác tính vào bất kỳ ngàynào từ D4 đến D28 kèm theo có KSTSR trong máu mà trước đó không cóbất kỳ tiêu chuẩn thất bại điều trị sớm nào; (ii) Có KSTSR trong máu và nhiệt độ nách ≥ 37,5°C vào bất kỳ ngàynào từ D4 đến D28 mà trước đó không có bất kỳ tiêu chuẩn thất bại điều trịsớm nào; + Thất bại KSTSR muộn (Late Parasitological Failure_LPF): Có ký sinh trùng trong máu vào bất kỳ ngày nào từ ngày D7 đến D28và nhiệt độ nách < 37,5°C mà trước đó không có tiêu chuẩn thất bại điều trịsớm hoặc thất bại điều trị muộn. - Đáp ứng lâm sàng và KSTSR đầy đủ (Adequate Clinical &Parasitological Respone_ACPR): Không có KSTSR trong máu vào ngày D28 không tính đến nhiệt độnách,trước đó không có bất kì tiêu chuẩn nào về thất bại điều trị sớm hoặc thấtbại lâm sàng muộn hoặc thất bại KSTSR muộn. Kỹ thuật in vitro Đây là thử nghiệm đánh giá ngưỡng nồng độ thuốc ức chế sự trưởng thành của thể nhẫn thành schizonte trong môi trường nuôi cấy 24-30 giờ có các nồng độ thuốc khác nhau: - Macrotest (hay kỹ thuật Rieckman macro test, 1968) Kỹ thuật này dựa trên đánh giá sự ức chế tư dưỡng P. falciparum phát triển thành thể schizonte trong môi trường nuôi cấycó glucose của ống chứng (không có thuốc) so với các ống chloroquin có nồngđộ thấp tăng lên cao dần (0,25-3nmol/ml). Bộ thử Macrotest do TCYTTG cung cấp. Kếtquả của kỹ thuật này phụ thuộc nhiều yếu tố (hấp thuthuốc, miễn dịch bệnh nhân. - Micro test (hay kỹ thuật Rieckmamm micro test, 1978) Dựa trên kết quả nuôi cấy liên tục P. falciparum bằng môi trường RPMI1640 của W.Trager và B .Jensen (1976), thay vì việc lấy l0 ml máu tĩnh mạch ởkỹ thuật Microtest, kỹ thuật Microtest chỉ lấy máu ở đầu ngón tay, cóthể thử được nhiều loại thuốc cùng lúc. Đánh giá kết quả dựa vào sự ức chếhoàn toàn thể tư dưỡng thành schizonte so với giếng chứng. Hiện nay, TCYTTG đã lưu hành rộng rãi bộ Microtestvới hầu hết các loạithuốc sốt rét đang sử dụng như chloroquin, amodiaquin, mefloquin, fancidar,halofantrin, artemisinin. Ưu điểm của Macrotest và Microtest đánh giá P. falcỉparum nhạy cảm hoặc kháng với
các thuốc ở điều kiện thực địa, giám sát sự nhạy cảm P. falciparum với thuốc nhằm phát hiện sự xuất hiện của kháng thuốc.Nhược điểm Macrotest và microtest là thử nghiệm khi áp dụng rộng rãi tại vùng SRLH, trang thiếtbị phức tạp, cán bộ thực hiện phải thành thạo về kỹnăng. -Test48giờ Kỹ thuật này tương tự như kỹ thuật microtest, trong microtest sử dụng 10%hồng cầu (HC) trong môi trường nuôỉ cấy P. falciparum RPMI 1640, trong kỹ thuật 48 giờ chỉ dùng 4%HC.Vì vậy, không cần thay môi trường, mà nuôi KSTSR trong 48 giờ. Phương pháp này rất có ích để đánh giá nhạy, kháng với CQ so sánhvới các thuốc khác, kể cả thuốc mới (artemisinin và các dẫnchất). Tuy nhiên, có nhược điểm trong 48 giờ thể schizonte vỡ ra, xâm nhập HC mới, nên phải đếm lượng KSTSR trên 10.000 HC; -Test 72 giờ P. falciparum nuôi cấy 3-4 ngày và được thích nghi ở điều kiện labo. Dịchtreo HC5%hồng cầu nhiễm KSTSR 3-15% pha loãng với HC lành để có mật độ KSTSR 0,3-0,5 HC nhiễm. Các đĩa nuôi cấybao gồm các đĩa có nồng độ thuốc khác nhau. Hàng ngày thay môi trườngkhông thuốc (chứng), đĩa có thuốc, sau 72 giờ lấy mẫu máu nuôi cấy làm tiêubản giọt mỏng, nhuộm giemsa đếm mật độ KSTSR/ 10.000 HC.
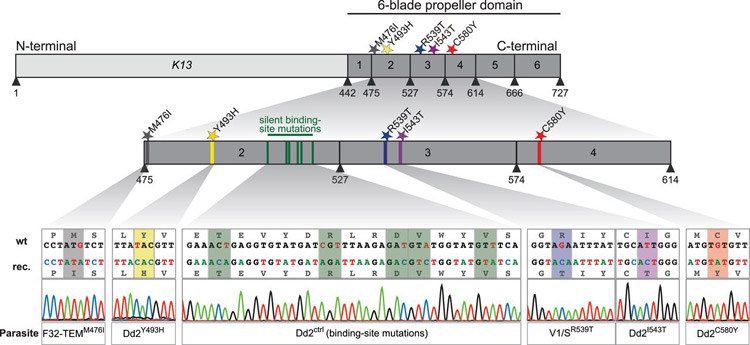
Phương pháp này đánh giá tính nhạy cảm của KSTSR với thuốc, xácđịnh nồng độ ức chế tối thiểu (MIC) và nồng độ ức chế có hiệu quả (EIC) của thuốc với KSTSR. Tuynhiên kỹ thuật này có nhược điểm là đòi hỏi phải trong điều kiện trang thiết bị hiện đại, kỹthuật phức tạp, thao tác thuần thục chuẩn xác. Thay môi trường hàng ngày, giáthành thử nghiệm cao. In-vitro RSA test (RSA0-3h WitkowskiB., 2013) Phương pháp này dùng để đánh giá độ nhạy của P.falciparum với thuốc mới artemisinin.Kỹ thuật thử nghiệm RSA0-3h được thực hiện trong môi trường nuôi cấyKST đồng bộ cao. KSTSR dạng thể nhẫn sau khi xâm nhiễm 0-3 giờ được chotiếp xúc với 700nM dihydroartemisinin hoặc dung dịch DMSO(dimethyl sulfoxide) trong 6 giờ, sau đó rửa và nuôi cấy KSTSR trong 66 giờ tiếptheo trong môi trường không có thuốc. Tỷ lệ KSTSR sống sót sẽ được tính toánbằng cách đếm dưới giọt mỏng nhuộm giêm sa. Nghiên cứu này hiên đang là thử nghiệm giúp hỗ trợ cho chẩn đoán xác định kháng thuốc artemisinin của P. falciparum bên cạnh các chỉ điểm D3 dương tính, chỉ điểm K13 propeller, đo nồng độ thuốc thử nghiệm. Chỉ thị phân tử để xác định KSTSR P. falciparumkháng artemisinin Ký sinh trùng P. falciaprum kháng với artemisinin và các dẫn suất tại nhiều vùng trong khu vực Đông Nam Á đe dọa các thành quả của chương trình phòng chống và loại trừ SR. Để giám sát hiệu lực thuốc và thực trạng kháng thuốc diễn ra quy mô nào thì việc phát hiện các chỉ điểm phân tử rất cần thiết. Liên quan giữa đột biến gen K13 đối với kháng artemisinin đang được các nhà khoa học quan tâm nghiên cứu. Tính đa hình các đột biến gen K13 được xác định có mặt tại nhiều tỉnh của Campuchia và gần đây được báo cáo tại nhiều nơi trên thế giới, đặc biệt khu vực tiểu vùng sông Mê Kông (Myanmar, Thái Lan, Việt Nam, Bangladesh, Lào). Trong nghiên cứu của Frederic Ariey và cộng sự (2014) nhằm phát hiện một chỉ điểm (marker) phân tử kháng artemisinin, dòng P. falciparum F32-ART5 kháng artemisinin đã được chọn lọc bằng phương pháp nuôi cấy liên tục từ dòng KSTSR nhạy cảm với artermisinin F32-Tanzania dưới áp lực thuốc artemisinin trong 125 chu kỳ trong 5 năm với liều tăng dần thuốc artemisinin. Bằng phương pháp giải trình trình tự toàn bộ gen F32-TEM (dòng KSTSR nuôi cấy không có áp lực artermisinin), F32-Tanzania hoặc 3D7 (dòng KST nhạy cảm với artermisinin), nhóm nghiên cứu đã phát hiện dòng KSTSR kháng ART F32-ART5 có tổng số 7 gen, mà mỗi gen chứa một mã codon đột biến so với các dòng KSTSR còn lại, trong khi dòng KSTSR nhạy không tìm thấy các đột biến này. Trong số những gen này, chỉ có gen PF3D7_1343700 cho thấy mối liên quan quan trọng với tỷ lệ sống sót của KSTSR trong thử nghiệm RSA0-3h. Gen PF3D7_1343700 nằm ở vị trí 5,9 kilobases ở phần đầu locus có trọng lượng phân tử 35kb và nằm trong vùng dấu hiệu ưu tiên để chọn lọc. Ngoài ra, các gen giả định liên quan đến kháng artemisinin (Pfcrt, Pftctp, Pfmdr1, Pfmrp1 và vận chuyển ABC) hoặc mã hóa các mục tiêu giả định của ART (PfATPase6 và Pfubcth-the orthologue Plasmodium chabaudi ubp1) đã không bị biến đổi trong quá trình lựa chọn 5 năm của F32-ART5 và không quan sát thấy gen Pfmdr1 khuếch đại. Ngoài ra trong nghiên cứu này đã có sự kết hợp các đột biến trên domain PF3D7 Kelch propeller (K13- propeller) với kháng thuốc artemisinin trên nghiên cứu thử nghiệm in vivo và in vitro. Do vậy đa hình đột biến gen K13 đã được ứng dụng để tạo ra chỉ thị phân tử để xác định kháng artemisinin vì một số lý do: - Có sự mất liên tiếp những chủng KSTSR kiểu hoang dại ở phía tâyCampuchia suốt giai đoạn bắt đầu có sự kháng artemisinin; - Kiểu KSTSR đột biến tăng lên về tần số tại các vùng kháng thuốc của Campuchia và xuất hiện rất ít ở những nơi kháng artemisinin là không phổ biến; - Gen PF3D7_1343700 nằm trong vùng dấu hiệu ưu tiên để chọn lọc; - Những đột biến đa dạng trên K13-propeller phản ánh chọn lọc dương; - Những đột biến xảy ra trên vùng gen có tính bảo tồn cao của P. falciparum, chỉ có một đột biến đa hình đơn nucleotide dạng SNPs (single nucleotide polymorphism)được ghi nhận từ một phân lập ở châu Phi; - Tất cả các kiểu đa hình được quan sát là khác thường (trừ kiểu V568G); - 3 đột biến có tần số cao nhất trong gen K13 có mối liên quan chặt chẽ với tỷ lệ RSA0-3h trong nghiên cứu in vitrotrên các mẫu phân lập và thời gian làm sạch 50% số lượng KSTSR trên bệnh nhân; - Tần xuất xuất hiện của những allen đột biến tương quanmạnh với tỷ lệ KSTSR dương tính ngày D3 sau khi điều trị bằng thuốc ACTs. Các nghiên cứu về đa hình đột biến gen K13 trên thế giới và Việt Nam Gen K13 hay Kelch 13 propeller domain gồm có 3 domain với 225 acid amin: · Một domain có đầu N có tính chất bảo tồn đặc trưng cho loài Plasmodium spp., · Một domain BTB/POZ và · Phía đầu C với 6 domain hình cánh quạt điển hình cho motif Kelch. Motif Kelch chứa protein được bảo tồn qua tiến hóa giữa các loài khác nhau và nhóm lại thành loại protein KLHL. Vật chủ là người chứa 42 protein trong protein KLHL. · Đa hình các điểm đột biến gen K13, còn được gọi là “vùng cánh quạt” của protein K13 đã được chứng minh có liên quan đến tỷ lệ sống còn của KSTSR trong thử nghiệm RSA0–3h, đồng thời có liên quan đến hiện tượng chậm làm sạch KSTSR hay giảm sự nhạy cảm của KSTSR với thuốc ở giai đoạn tư dưỡng và tỷ lệ KSTSR dương tính vào ngày thứ 3 (giờ thứ 72) ở bệnh nhân điều trị SR do P. falciparum với ACTs. Theo Frederic Ariey và cộng sự (2014), đa hình đột biến trên protein cánh quạt K13 tập trung tại các tỉnh Campuchia, nơi hiện tình trạng kháng artermisinin diễn ra phổ biến và các tần số các alen đột biến trên protein K13 ngày càng tăng có liên quan đến sự lây lan của kháng artemisinin ở khu vực phía tây Campuchia. Nghiên cứu cũng cho thấy mối tương quan chặt chẽ giữa sự hiện diện của alen đột biến, tỷ lệ KSTSR sống sót trong thử nghiệm in vitro, giống nghiên cứu thử nghiệm ex vivo (Witkowski. B và cs., 2013)và tỷ lệ làm sạch KSTSR trong thử nghiệm in vivo. Mối tương quan này đã chỉ ra rằng đột biến K13 - cánh quạt là yếu tố quyết định quan trọng của cơ chế kháng artermisinin và nghiên cứu của Frederic Ariey và cộng sự (2014) cũng đã xác định đa hình các đột biến trên protein K13 như một marker phân tử kháng arermisinin của P. falciparum.
 | | Phân bố các đột biến K13 theo mô hình 3D của K13 propeller domain |
Đồng thời nghiên cứu của Frederic Ariey và cộng sự cũng đã xác định được 17 alen đột biến trên protein K13 ở Campuchia. Mặc dù đã xác định được một số lượng lớn các đột biến, chỉ có một số alen đột biến có tần số cao (> 5%), có chứa đột biến SNPs, cụ thể là Y493H, R539T và C580Y nằm tương ứng ở vị trí cánh quạt 2, 3 và 4. Nghiên cứu này đã lập bản đồ các điểm đột biến xác định tỷ lệ KSTSR có chứa các đột biến có nghĩa và sự phân bố địa lý của chúng. Quan trọng hơn, sự phân bố tần số của alen đột biến tại các tỉnh khác nhau cũng phù hợp với tỷ lệ tồn tại KSTSR ở ngày D3 ở bệnh nhân sau khi được điều trị bệnh SR do P. falciparum với thuốc phối hợp ACTs. Hiện tượng này được xem là chỉ điểm gợi ý cho kháng artemisinin trong điều trị lâm sàng. Một nghiên cứu khác tại Campuchia của Pharath Lim và cộng sự (2013) cho biết trong khi P. falciparum đa kháng thuốc có mặt phổ biến ở khu vực phía Tây và phía Bắc Campuchia, hiện không có bằng chứng nào cho thấy có hiện tượng kháng piperaquin, điều này cũng xảy ra tương tự ở Thái Lan. Pharath Lim và cộng sự cũng lần đầu tiên nghiên cứu liệu sự gia tăng số lượng bản sao của ‘X5r’- một vùng nằm trên nhiễm sắc thể số 5, là dấu hiệu di truyền liên quan đến dòng P. falciparum PPQR4 được chọn lọc với nồng độ PPQ IC50 cao, có tương quan với việc giảm tính nhạy cảm PPQ của ký sinh trùng trong thử nghiệm lâm sàng ex vivo. Kết quả nghiên cứu đề xuất rằng tất cả các trương hợp kháng ART sau khi điều trị bằng ACTs tại Campuchia tại thời điểm nghiên cứu chủ yếu là do kháng artermisinin.
 |  | | Hình 3. Đa hình và tần số đột biến K13 propeller ở một số tỉnh Campuchia (2014) |
Ngoài ra, nghiên cứu của Ashley và cộng sự (2014) tại các nước Đông Nam Á và một số nước châu Phi như Nigeria, Congo, Kenya đã chỉ ra tình trạng chậm làm sạch KSTSR (thời gian làm sạch ½ KST > 5 giờ), cũng liên quan chặt chẽ với các đột biến điểm trên K13-propeller. Trong nghiên cứu này, các đột biến cánh quạt K13 có 91,8% độ nhạy và độ đặc hiệu 88,4% với thời gian làm sạch 50% dung khối KSTSR > 5 giờ. Tuy nhiên, việc kháng thuốc artemisinin lây lan chủ yếu là tại các nước Đông Nam Á. Nghiên cứu từ 2007 đến 2012 tại biên giới Trung Quốc và Myanmar cũng đã xác định được 17 đột biến gen K13 với 7 loại đột biến mới. Đột biến F446I chiếm ưu thế với 27,2%, C580Y xuất hiện với tần số thấp 1,6% và có sự gia tăng về tần số KSTSR mang gen đột biến theo từng năm. Tuy nhiên, lại không tìm thấy các đột biến I543T, R539T và Y493H liên quan đến tình trạng chậm làm sạch KSTSR như ở Campuchia, kể cà M476I. Đi kèm là tỷ lệ tồn tại KSTSR ngày D3 tại khu vực này là > 10%, cần có những nghiên cứu tiếp theo về khả năng kháng artemisinin lan rộng sang các nước thuộc tiểu vùng Mê Kông. Tại Việt Nam, nghiên cứu của Kamala Thriemer và cộng sự (2015) tại Quảng Nam, từ 2012-2013, trong 83 mẫu phân lập được phân tích về mặt phân tử có 67 mẫu có mang đột biến gen K13 tại vị trí 543 và 493, không tìm thấy đột biến tại vị trí 539 và 580. Mẫu phân lập mang đột biến tại vị trí 543 có thời gian làm sạch KSTSR cao hơn đáng kể so với mẫu mang đột biến dạng hoang dại (WT_wild-type). Độ nhạy, độ đặc hiệu của đột biến SNPs 543 với tình trạng chậm làm sạch KSTSR thể vô tính P. falciparum lần lượt là 91,4% và 27,1%. Với tỷ lệ tồn tại KSTSR ngày D3 gần 30%, điểm theo dõi của Nam Trà My (Quảng Nam) cùng với điểm Phú Thiện (Gia Lai) được TCYTTG đánh giá là khu vực đầu tiên của Việt Nam không có giao lưu biên giới nghi ngờ xuất hiện kháng thuốc artemisinin. Mặt khác, theo nghiên cứu tiến hành tại Bangladesh, Abu Naser Mohon và cộng sự (2014) đã phát hiện thêm một đột biến tại vị trí A578S, đột biến này nằm gần vị trí với đột biến đã biết là C580Y ở Đông Nam Á. Theo tác giả, đột biến này gây ra sự thay đổi cấu trúc không gian của protein bằng cách thay đổi bề mặt tương tác với protein khác dẫn đến biến đổi chức năng sinh học của protein, làm ảnh hưởng đến các hoạt động của artermisinin, kết quả là thời gian làm sạch KSTSR bị kéo dài (Ashley và cs., 2014). Tuy nhiên, đột biến này không liên quan đến việc tăng thời gian làm sạch ½ KSTSR (parasite clerance half-life) hay nói cách khác là không liên quan đến kháng artemisinin. Dẫn liệu đã chứng minh rằng đột biến liên quan chặt chẽ với kháng artemisinin là không có mặt ở Bangladesh. Việc xác định liệu kháng artemisinin gây ra sự lây lan hay là độc lập với sự nổi lên do sốt rét tại khu vực biên giới Campuchia-Thái Lan là điều hết sức cần thiết. Nếu vấn đề kháng thuốc tồn tại ở một khu vực nhỏ, nó có thể được kiểm soát và loại trừ, ngược lại kháng thuốc có thể lây lan sang các nước lân cận như Việt Nam, Lào, Myanmar khi đó sẽ là thảm họa phức tạp. Theo Rie Isozumi và cộng sự (2015) tại Kenya, đã xác định được 4 đột biếncó ý nghĩa và 5 đột biến “im lặng” ở vùng bảo tồn cao của gen K13 trên P. falciparum và các đột biến này có tính chất xuất hiện chưa rõ ràng. Tuy nhiên, những đột biến này không giống với công bố của Arieyvà cộng sự năm 2014. Tác giả đã tìm ra đột biến A78S tại quần đảo Mangano. Tương tự như nghiên cứu của Abu Naser Mohon tại Bangladesh, tác giả cũng cho rằng đột biến này làm biến đổi acid amin từ dạng kỵ nước sang dạngưa nước, nằm gần vị trí với đột biến C580Y (được xác định tại Campuchia), ảnh hưởng đếntương tác protein-protein, điều này làm ảnh hưởng đến tính nhạy của KSTSR với artemisinin. Tại Myanmar, P. falciparum kháng artemisinin được được báo cáo tại khu vực biên giới Myanmar- Thái Lan từ nhiều năm trước và tình trạng chậm làm sạch KSTSR sau khi điều trị với ACTs cũng được xác định ở miền Nam Myanmar trong những năm gần đây (Kyaw MP và cs., 2013). Trong 2011-2012, dẫn liệu cho thấy tỷ lệ chậm làm sạch KSTSR là 15%, với thời gian làm sạch ½ số lượng KST (parasite clearance half-life) là > 5 giờ và khoảng 25% số ca có mang các đột biến gen K13 (Ashley EA và cs., 2014). Nghiên cứu đánh giá sự hiện diện tính đa hình các đột biến trên protein K13 hiện nay tiếp tục được thực hiện với các mẫu giấy thấm thu thập tại Myanmar trong suốt nghiên cứu về hiệu quả phương pháp điều trị trong thời gian 2012-2013 nhằm mục đích lập bản đồ mức độ kháng artemisinin và đáp ứng khẩn cấp các hoạt động ngăn chặn phù hợp. Nghiên cứu trong năm 2013-2014, đã xác định được 29 đột biến khác nhau tại vị trí sau acid amin 210, với 26 đột biến trong số đó nằm sau vị trí acid amin 440 (cho thấy hầu hết các đột biến này nằm tập trung tại vùng cánh quạt đầu tiên, từ acid amin 441-475) với 3 đột biến có tần số cao nhất lần lượt là C580Y, F446I và P574L và nhiều đột biến khác, phần lớn các đột biến này đã được xác định trong các nghiên cứu tại Campuchia và gần đây ở Việt Nam, Myanmar, Thái Lan và Lào. Đặc biệt, sự có mặt của đột biến M476I do quá trình chọn lọc trong thời gian dài với áp lực thuốc artemisinin (Feredic Ariey và cs., 2014). Đột biến C580Y được cho là liên quan đến tình trạng chậm làm sạch KSTSR có mặt ở khu vực biên giới của Myanmar-Thái Lan với tần số cao nhất, tiếp theo đó là F446I ở khu vực gần biên giới Ấn Độ. Trong khi sự phân bố khác nhau của các đột biến tại các vùng địa lý khác nhau chưa được làm rõ nhưng có thể giải thích rằng Myanmar đang ở giai đoạn đầu của quá trình tiến hóa (so với các điểm ở Campuchia) và có thể xem như một loại đột biến . Những đột biến ở Myanmar cho thấy sự giảm mức độ kháng artemisinin, có thể là do có sự chọn lọc đặc biệt từ việc sử dụng thuốc SR, tính di truyền của vật chủ hoặc muỗi sinh học có thể dẫn đến sự phân bố khác nhau về các đột biến ở 2 vùng phía Nam và bắc Myanmar. Cần có những nghiên cứu sâu hơn về sự thích ứng của KSTSR và độ nhạy với thuốc SR có thể giải đáp câu hỏi này. Amed Ouattara và cộng sự đã tiến hành một nghiên cứu tại Mali, nơi mà kháng artemisinin dẫn đến tình trạng chậm làm sạch KSTSR là chưa được báo cáo, kết quả thu được một số đột biến gen K13 với tần số thấp. Tuy nhiên, các đột biến được cho là liên quan chặt chẽ đến tình trạng chậm làm sạch KST tìm thấy tại các nước Đông Nam Á là không có mặt ở Mali. Các đột biến tìm thấy tại Mali nằm trên miền protein có liên quan đến việc kéo dài thời gian làm sạch KSTSR. Do vậy, nghiên cứu xác định không có mối tương quan giữa đột biến K13 và kháng artemisinin tại Mali, tương tự các nghiên cứu tại 14 quốc gia khác tại châu Phi (Taylor SM và cs., 2014). Nghiên cứu tại Senegal từ 2012-2013, chỉ phát hiện 2 đột biến gen K13 là T149S và K189T, không phát hiện các đột biến liên quan đến kháng artemisinin đã được xác định tại Đông Nam Á (Torrentino-Madamet M và cs., 2014). Nghiên cứu tại Uganda đánh giá sự liên quan giữa đột biến gen K13 và Falcipain-2 với tình trạng kháng artemisinin. Loại Falcipain-2 hay cysteine protease falcipain-2 (FP2; PF3D7_1115700) là một enzym protease thủy phân hemoglobine của hồng cầu vật chủ. Đột biến tại codon 69 dẫn đến gián đoạn gen Falcipain-2 có thể “khóa lại” quá trình thủy phân hemoglobin, dẫn đến KSTSR tăng nhạy cảm với các chất ức chế protease và kết quả là làm giảm hoạt động của artemisinin (Rosenthal PJ và cs., 2011). Phân tích về mặt phân tử, ngoài sự có mặt một số đột biến không liên quan đến kháng artemisinin, không thấy có mặt các đột biến C580Y, R539T hay Y493H, là những đột biến liên quan chặt chẽ với tình trạng chậm làm sạch KSTSR tại các nước Đông Nam Á, kể cả đột biến M476I. Như vậy, sự hạn chế về đa hình các đột biến gen K13 và đa dạng trong cấu trúc gen Falcipain-2 không thay đổi trước và sau khi sử dụng ACTs một cách rộng rãi để điều trị SR do P. falciparum cho thấy đột biến gen K13 không ảnh hưởng đến việc điều trị bằng ACTs và ACTs vẫn là thuốc điều trị sốt rét P. falciparum hiệu quả tại quốc gia này (Melissa D. Conrad và cs., 2014). Tất cả kết quả trên cho thấy mối quan tâm đến kháng thuốc artemisinin trở thành vấn đề cấp bách tại Việt Nam, một quốc gia chia sẻ với dải biên giới dài với Campuchia, Lào, Trung Quốc, đặc biệt là các tỉnh miền Trung-Tây Nguyên, nơi có tỷ lệ mắc và tử vong cao do sốt rét hàng năm và các nguy cơ giảm hiệu lực DHA-PPQ, thậm chí thất bại điều trị hoặc kháng là có thể rất cao. Vấn đề cần thiết hiện nay vẫn đang thiếu một marker phân tử có ý nghĩa trong việc kiểm soát sự lây lan của P.falciparum kháng với artermisinin trong điều trị lâm sàng, điều này đã cản trở việc tập trung ngăn chặn KSTSR kháng artemisinin tại các khu vực đã được ghi nhận là có tình trạng kháng artemisinin và gây ảnh hưởng đến việc phát hiện nhanh KSTSR ở những nơi khác, nơi ACTs vẫn là thuốc chống sốt rét hiệu quả và giá hợp lý. Nhìn chung, đột biến K13 cung cấp một công cụ phân tử mới tiềm năng đối với kháng artemisinin, có liên quan đến quá trình làm sạch KSTSR thể vô tính tại các điểm kháng thuốc. Nhiều đột biến K13tồn tại, song không phải luôn luôn tỷ lệthuận với sự làm sạch chậm KSTSR sau điều trị artesunate hoặc dẫn suất. Xuất hiện kháng artemisinin và lan rộng dường như độc lập với nhau, do đó cần thiết phải hiểu và làm rõ vai tròchỉ điểm phân tử K13 để giám sát kháng artemisinin cho phù hợp. Trong khi nghiên cứu và đưa ra một loại vaccine hiệu quả ngăn ngừa bệnh vẫn còn trong giai đoạn thử nghiệm cuối cùng. Trong khi đó, bối cảnh tình hình ký sinh trùng P. falciparum kháng với thuốc artemisinins và các dẫn suất, đồng thời có xu hướng giảm nhạy với nhiều loại thuốc phối hợp có thành phần artemisinin hoặc dẫn suất của artemisinins (artemisinine, artemether, dihydroartemisinin, artemotil) thông qua chỉ số gián tiếp lâm sàng D3 dương tính trên 10%, thậm chí có nơi cao đến 36% (Việt Nam) hoặc lên đến 45% (Campuchia) kèm theo chỉ điểm phân tử đột biến K13 propeller điển hình mà TCYTTG đã xác định hoặc xác định có liên quan đến kháng thuốc do P. falciparum. Điểm thú vị về kháng thuốc artemisinin đã được phát hiện không những vùng sốt rét có giao lưu biên giới với Campuchia, Lào, Myanmar, Việt Nam, Bangladesh, Ấn Độ, Trung Quốc, Nepal, Papua New Guinea, Indonedia, Thái Lan, ...mà còn xuất hiện và đang có mặt tại nhiều vùng nội địa, cách xa biên giới với các quốc gia láng giềng. Do đó, việc nghiên cứu và phát triển các ứng cử viên thuốc mới dạng phối hợp có thành phần artemisinin hoặc không có thành phần artemisinin (ACTs và non-ACTs) như KAF 156 và KAE 609 đang thực hiện tại nhiều vùng sốt rét lưu hành nhiều quốc gia, trong đó có Việt Nam. Tài liệu tham khảo 1.Amaratunga C, Sreng S, Suon S, Phelps ES et al., (2012). Artemisinin-resistant Plasmodium falciparum in Pursat province, western Cambodia: A parasite clearance rate study. The Lancet Infectious Diseases, 12(11):851-858. 2.Anderson TJ, Nair S, Nkhoma S, Williams JT et al., (2010). High heritability of malaria parasite clearance rate indicates a genetic basis for artemisinin resistance in western Cambodia. J Infect Dis, 201(9):1326-1330. 3.Ariey F, Witkowski B, Amaratunga C, Beghain J et al., (2014). A molecular marker of artemisinin-resistant Plasmodium falciparum malaria. Nature, 505(7481):50-55. 4.Ashley EA, Dhorda M, Fairhurst RM, Amaratunga C et al., (2014). Tracking resistance to artemisinin. Spread of artemisinin resistance in Plasmodium falciparum malaria. N Engl J Med, 371(5):411-423. 5.Bassat Q, Mulenga M, Tinto H, Piola P, et al., (2009). Dihydroartemisinin-piperaquine and artemether-lumefantrin for treating uncomplicated malaria in African children: A randomised, non-inferiority trial. PloS one, 4(11):1-10. 6.Chavchich M, Gerena L, Peters J, Chen N, Cheng Q et al., (2010). Role of pfmdr1 amplification and expression in induction of resistance to artemisinin derivatives in Plasmodium falciparum. Antimicrob Agents Chemother, 54(6):2455-2464. 7.Chotivanich K, Tripura R, Das D, Yi P et al., (2014). Laboratory detection of artemisinin-resistant Plasmodium falciparum. Antimicrob Agents Chemother, 58(6):3157-3161. 8.Dondorp AM, Nosten F, Yi P, Das D et al., (2009). Artemisinin resistance in Plasmodium falciparum malaria. N Engl J Med, 361(5):455-467. 9.Dondorp AM, Fairhurst RM, Slutsker L et al., (2011). The threat of artemisinin-resistant malaria. The New England journal of medicine, 365(12):1073-1075. 10.Eastman RT, Dharia NV, Winzeler EA, Fidock DA (2011). Piperaquine resistance is associated with a copy number variation on chromosome 5 in drug-pressured Plasmodium falciparum parasites. Antimicrob Agents Chemother, 55(8): 3908-3916. 11.Fairhurst RM, Nayyar GM, Breman JG et al., (2012). Artemisinin-resistant malaria: research challenges, opportunities, and public health implications. Am J Trop Med Hyg, 87(2):231-241. 12.Hien TT, Thuy-Nhien NT, Phu NH, Boni MF et al., (2012). In vivo susceptibility of Plasmodium falciparum to artesunate in Binh Phuoc Province, Vietnam. Malaria journal, 11(1):355. 13.Hien TT, Dolecek C, Mai PP, Dung NT, Truong NT et al., (2004). Dihydroartemisinin-piperaquine against multidrug-resistant Plasmodium falciparum malaria in Vietnam: randomised clinical trial. Lancet, 363:18-22. 14.Hunt P, Martinelli A, Modrzynska K, Borges S et al., (2010). Experimental evolution, genetic analysis and genome re-sequencing reveal the mutation conferring artemisinin resistance in an isogenic lineage of malaria parasites. BMC Genomics, 11:499. 15.Lim P, Dek D, Try V, Eastman RT, Chy S et al., (2013). Ex vivo susceptibility of Plasmodium falciparum to antimalarial drugs in western, northern, and eastern Cambodia, 2011-2012: association with molecular markers. Antimicrob Agents Chemother, 57(11):5277-5283. 16.Noedl H, Se Y, Schaecher K, Smith BL, Socheat D, Fukuda MM (2008). Evidence of artemisinin-resistant malaria in western Cambodia. N Engl J Med, 359(24):2619-2620. 17.Phyo AP, et al., (2012). Emergence of artemisinin-resistant malaria on the western border of Thailand: a longitudinal study. Lancet, 379(9830):1960-1966. 18.Song J, Socheat D, Tan B, Seila S, Xu Y, Ou F et al., (2011). Randomized trials of artemisinin-piperaquine, dihydroartemisinin-piperaquine phosphate and artemether-lumefantrine for the treatment of multi-drug resistant falciparum malaria in Cambodia-Thailand border area. Malar J, 10:231. 19.Takala-Harrison S, Clark TG, Jacob CG et al., (2013). Genetic loci associated with delayed clearance of Plasmodium falciparum following artemisinin treatment in Southeast Asia. Proceedings of the National Academy of Sciences of the United States of America, 110(1):240-245. 20.N.X. Thanh, Trung TN, Phong NC, Thien NX, Dai B, Shanks GD, Chavchich M, Edstein MD et al. (2009), “Open label randomized comparison of dihydroartemisinin-piperaquine and artesunate-amodiaquine for the treatment of uncomplicated Plasmodium falciparum malaria in central Vietnam”. Trop Med Int Health. 2009 May;14(5):504-11. 21.N.X. Thanh, T.N. Trung, N.C. Phong, H.H. Quang, B. Dai, George D. Shanks, Marina Chavchich, Michael D. Edstein (2012), “The efficacy and tolerability of artemisinin - piperaquine (Artequick(R)) versus artesunate - amodiaquine (CoarsucamTM) for the treatment of uncomplicated Plasmodium falciparum malaria in South-central Vietnam”, Malaria Journal 2012, 11:217. 22.N.X. Thanh, T.N. Trung, N.C. Phong, H.H. Quang, B. Dai, George D. Shanks, Marina Chavchich, Michael D. Edstein (2012), “Efficacy of artesunate alone and Artesunate plus Azithromycin for the treatment of uncomplicated Plasmodium falciparum malaria in Vietnam”, Abstract for the 61st Annual meeting of the American Society of Tropical Medicine and Hygiene, Nov.11-15, Atlanta, USA. 23.Thanh NV, Toan TQ, Cowman AF, Casey GJ et al., (2010). Monitoring for Plasmodium falciparum drug resistance to artemisinin and artesunate in Binh Phuoc Province, Vietnam: 1998-2009. Malaria journal, 9:181. 24.Thriemer K, Hong N, Rosanas-Urgell A, Phuc B et al., (2014). Delayed parasite clearance after treatment with dihydroartemisinin-piperaquine in Plasmodium falciparum Malaria Patients in Central Vietnam. Antimicrob. Agents Chemother, 58(12):7049-7055. 25.Tjitra E, Hasugian AR, Siswantoro H, Prasetyorini B et al., (2012). Efficacy and safety of artemisinin-naphthoquine versus dihydroartemisinin-piperaquine in adult patients with uncomplicated malaria: A multi-centre study in Indonesia. Malaria journal, 11:153. 26.Trung TN, Davis TM, Hewitt S, Thuan LK, Quang HH et al., (2001), “Treatment of falciparum malaria in Vietnamese children: the need for combination therapy and optimised dosage regimes”, Annals of Tropical Paediatrics: International Child Health, Volume 21, Number 4, 1 December 2001 , pp. 307-312(6). 27.Veiga MI, Ferreira PE, Malmberg M, Jörnhagen L et al., (2012). pfmdr1 amplification is related to increased Plasmodium falciparum in vitro sensitivity to the bisquinoline piperaquine. Antimicrobial Agents and Chemotherapy, 56:3615-3619. 28.Winzeler EA, Manary MJ (2014). Review: Drug resistance genomics of the antimalarial drug artemisinin. Genome Biology, 15(11):544. 29.Witkowski B, Lelievre J, Barragan MJ, Laurent V et al., (2010). Increased tolerance to artemisinin in Plasmodium falciparum is mediated by a quiescence mechanism. Antimicrob Agents Chemother, 54(5):1872-1877. 30.Witkowski B, Khim N, Chim P, Kim S, Ke S et al., (2013). Reduced artemisinin susceptibility of Plasmodium falciparum ring stages in western Cambodia. Antimicrobial agents and chemotherapy, 57(2):914-923. 31.Dhanoa BS, Cogliati T, Satish AG, Bruford EA, Friedman JS (2013). Update on the Kelch-like (KLHL) gene family. Human Genomics, 7(13). 32.Eckstein-Ludwig U, Webb RJ, Van Goethem Ida et al., (2003). Artemisinins target the SERCA of Plasmodium falciparum. Nature, 424(6951):957-961. 33.Gaaib JN, Nassief AF, Al-Assi AH (2011). Simple salting-out method for genomic DNA extraction from whole. Tikrit Journal of Pure Science16(2). 34.Kamau E, Alemayehu S, Feghali KC, Saunders D, Ockenhouse CF (2013). Multiplex qPCR for detection and absolute quantification of malaria. PLoS one, 8(8):e71539. 35.Na-Bangchang K, Karbwang J (2013). Emerging artemisinin resistance in the border areas of Thailand. Expert review of clinical pharmacology, 6:307-322. 36.Nasiri H, Forouzandeh M, Rasaee MJ, Rahbarizadeh F (2005). Modified salting-out method: high-yield, high-quality genomic DNA extraction from whole blood using laundry detergent. J Clin Lab Anal, 19(6):229-232. 37.WHO (2013), Emergency response to artemisinin resistance in the greater Mekong subregion, Regional framework for action 2013-2015 38.WHO (2013), Updated WHO Policy Recommendation: Single dose Primaquine as a gametocytocide in Plasmodium falciparum malaria
|

