Những thành quả đạt được của Chương trình quốc gia phòng chống sốt rét không thể không kể đến hiệu lực các thuốc sốt rét. Tuy nhiên, sự xuất hiện và lan rộng ký sinh trùng sốt rét kháng thuốc là một vấn đề nghiêm trọng đe dọa đến thành quả phòng chống sốt rét và kháng lại hầu hết các thuốc sốt rét kinh điển và thường dùng.
Sốt rét vẫn là vấn đề y tế công cộng quan trọng, mỗi năm gây ra cái chết cho khoảng 1.5 triệu người ở vùng nhiệt đới và cận nhiệt đới, đặc biệt khu vực cận sa mạc Sahara, châu Phi và châu Á. Các dẫn suất của artemisinin ra đời đã tác động rất lớn về mặt lâm sàng trong điều trị và chống kháng sốt rét kháng thuốc. Tuy nhiên, kinh nghiệm cho thấy tình trạng kháng thuốc xảy ra cũng là lúc “tuổi thọ” của thuốc sốt rét giảm đi. Nếu không có biện pháp và hoạt động giám sát thường xuyên về tình hình kháng thuốc thì việc đầu tư vào nghiên cứu phát minh ra thuốc mới sẽ rất lãng phí. Do vậy, song song với thử nghiệm lâm sàng một số thuốc sốt rét mới thì việc đánh giá hiệu quả của phác đồ một số thuốc sốt rét cổ điển cũng không kém phần quan trọng để đưa ra chiến lược kịp thời, đồng thời giúp xây dựng bản đồ kháng thuốc sốt rét. Đánh giá hiệu lực thuốc sốt rét là một hoạt động cần thiết và rất quan trọng nhằm khẳng định hiệu quả của các thuốc sốt rét hiện đang dùng, đồng thời thử nghiệm các thuốc mới có tiềm năng thay thế thuốc cũ, độc tính cao hoặc bị đa kháng. Đây là công việc thường quy tại thực địa cũng như tại la bô. Nhiều phương pháp và kỹ thuật khác nhau giúp hoặc hỗ trợ cho đánh giá hiệu lực của các thuốc điều trị sốt rét như kỹ thuật in vivo, in vitro, bioassay, phương pháp sinh học phân tử như PCR, nested-PCR, định lượng hoạt chất hoặc chất chuyển hóa đang điều trị trong huyết tương bệnh nhân, huyết thanh miễn dịch...Song, chưa có một phương pháp nào tối ưu và có thể khẳng định về hiệu lực thuốc một cách thấu đáo nhất, nên các phương pháp hoặc kỹ thuật như trên đều có những ưu và nhược điểm riêng, cần phối hợp với nhau đồng thời trên một nghiên cứu sẽ giúp xác định chi tiết tính nhạy, kháng của các thuốc vớiký sinh trùng sốt rét, đặc biệt hai loài P. falciparum và P. vivax. Trong khi chờ đợi các vaccine phòng bệnh đặc hiệu cho cộng đồng thì việc trì hoãn kháng thuốc là vấn đề cần thiết và khẩn cấp phải làm và cần có sự hỗ trợ chính sách và kinh phí cho hoạt động giám sát hiệu lực thuốc sốt rét thường quy.
Hiện nay, các ký sinh trùng Plasmodium sp. gây bệnh sốt rét đang phát triển khả năng kháng thuốc, vì vậy các nhà nghiên cứu phải thường xuyên tìm kiếm các liệu pháp điều trị mới. Trong quá trình tìm kiếm khám phá đó, nhóm các nhà nghiên cứu Scripps và Viện Nghiên cứu các bệnh nhiệt đới Novartis ở Singapore đã tìm ra một hợp chất có khả năng điều trị ký sinh trùng sốt rét (KSTSR) ở chuột chỉ bằng một liều thuốc duy nhất. Nhóm nghiên cứu đã phát triển loại thuốc này bằng cách sàng lọc danh mục 12.000 hợp chất sau đó tạo ra dẫn xuất của những hợp chất có triển vọng nhất (cách nghiên cứu này tương tự như trước đây giáo sư người Trung Quốc nhận giải Nobel đã từng nghiên cứu). Sau khi thử nghiệm các chất dẫn xuất này, các nhà nghiên cứu đã tập trung vào một hợp chất có tên spiroindolon, được gọi là NITD609. Hợp chất này có cơ chế tác dụng dự đoán sẽ tác động vào một loại protein của KSTSR mà các loại thuốc sốt rét hiện nay không tác động theo cách đó. Theo các nhà nghiên cứu, NITD609 ngăn chặn nhanh quá trình tổng hợp protein trong ký sinh trùng sốt rét bằng cách ngăn chặn gene trong adenosin triphosphataza có chức năng vận chuyển các cation qua màng tế bào. Do tác nhân chống sốt rét này hoạt động theo một cơ chế khác với các thuốc chống sốt rét hiện nay nên nó có hiệu quả chống lại các chủng ký sinh trùng sốt rét đã kháng thuốc. Nếu các nghiên cứu về dược lý và an toàn thành công, các nhà nghiên cứu sẽ bắt đầu thử nghiệm thử nghiệm lâm sàng giai đoạn 1 vào cuối năm nay. Kết quả bước đầu của nghiên cứu mới này mở ra hy vọng điều trị bệnh sốt rét - Một trong những căn bệnh đang gây tử vong cho gần 1 triệu người mỗi năm trên phạm vi toàn cầu.
Giám sát chỉ điểm phân tử K13 để giám sát sự lan rộng của P. falciparum kháng artemisinin
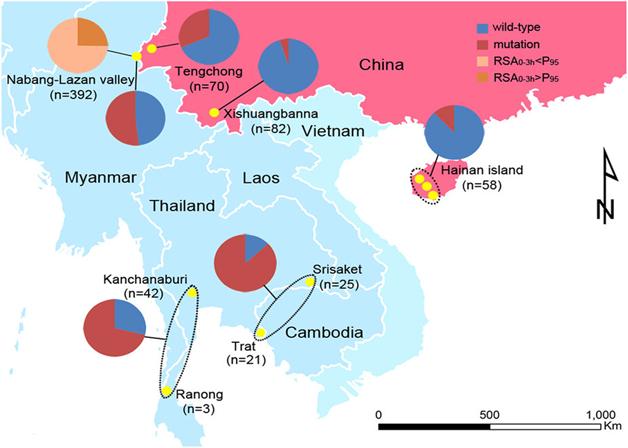
Liệu pháp điều trị thuốc phối hợp có thành phần artemisinin/ hay dẫn suất là phương pháp điều trị chính cho bệnh sốt rét do P. falciparum trên toàn cầu, nhưng artemisinin đã bị kháng thông qua bằng chứng là sự trì hoãn hay chậm làm sạch ký sinh trùng sốt rét (KSTSR) sau khi điều trị liệu pháp artemisinin (ACTs), hiện đã lan rộng và phổ biến trên một khu vực rộng lớn ở nhiều quốc gia Đông Nam châu Á. Kháng artemisinin đặc trưng bởi sự giảm tính nhạy của các thể tư dưỡng non trong quá trình phát triển của ký sinh trùng và rõ ràng là có liên quan tới tăng tỷ lệ thất bại (treatment failure rate) trong phương pháp điều trị kết hợp có thành phần artemisinin ở khu vực biên giới Campuchia và Thái Lan. Đột biến có thay đổi trình tự các acide amin chủ yếu và được gọi là vùng cánh quạt (propeller) của các protein Kelch chứa gen K13, đã được xác định là một yếu tố chính quyết định gây ra kháng artemisinin ở Đông Nam Á, hoạt động thông qua tăng điều hòa và tạo ra phản ứng của protein. Các đột biến ở propeller K13 khác nhau được ghi nhận trong các nghiên cứu khảo sát ở cộng đồng dân cư trong khu vực và các kiểu hình với số lượng đủ để có ý nghĩa thống kê, các đột biến phổ biến hầu hết có liên quan đến trì quá trình chậm làm sạch KSTSR sau khi điều trị liệu pháp có artemisinin và giảm đáp ứng trên thử nghiệm in vitro. Xảy ra đột biến không thường xuyên ở vùng cánh quạt (propeller) và vẫn chưa xác định được là có liên quan tới tỷ lệ làm sạch ký sinh trùng bình thường. Các nghiên cứu dựa trên chứng cứ cho thấy bằng chứng số liệu ngày càng tăng ở các vùng cách xa khu vực xác định kháng artemisinin ban đầu, các đột biến K13 propeller không hiện diện ở những tần số đáng kể và tổng số tỷ lệ đột biến propeller K13 nhỏ hơn 5% từ một loạt nghiên cứu khảo sát nhiễm sốt rét đơn thuần P. falciparum. Khám phá và nghiên cứu các marker (chỉ điểm) phân tử kháng thuốc artemisinin trước khi nó lan rộng ra toàn cầu cung cấp một cơ hội duy nhất cho việc giám sát được thực hiện trong thời gian gần để hỗ trợ cho các chiến lược ngăn chặn và loại trừ sốt rét. Tổ chức Y tế thế giới (TCYTTG) đã kết hợp số liệu giám sát các chỉ điểm propeller K13 để điều chỉnh và cập nhật về định nghĩa của kháng artemisinins. Kháng artemisinins ở P. falciparum đã xuất hiện tại biên giới Myanmar-Thái Lan trong nhiều năm và chậm làm sạch ký sinh trùng sau khi điều trị kết hợp artemisinin (ACTs) cũng được ghi nhận ở đông nam Myanmar. Nghiên cứu này trình bày một khảo sát chi tiết phân tử K13 của P. falciparum phân lập được từ các bệnh nhân ở Myanmar và các vùng lân cận đó. Các nghiên cứu được thiết kế và thu thập mẫu cho kiểu gen K13 từ bệnh nhân có biểu hiện triệu chứng sốt rét từ các trung tâm điều trị tại 55 điểm nghiên cứu trong mười khu vực hành chính ở Myanmar và hai khu vực xuyên biên giới Thái Lan và Bangladesh. Bệnh nhân mắc sốt rét do P. falciparum xác định bằng xét nghiệm lam máu nhuộm giêm sa hoặc xét nghiệm chẩn đoán nhanh (RDTs). Trong một nhóm nhỏ của những bệnh nhân này, cả hai sàng lọc chẩn đoán nhanh và toàn bộ mẫu máu được xử lý để kiểm tra sự phù hợp. Các thành phần DNA được tách chiết từ những giọt máu khô thu thập vào mẫu giấy thấm, hay que thử chẩn đoán nhanh (cả hai được lưu trữ và làm khô tại nhiệt độ phòng) và các mẫu máu còn nguyên vẹn đông lạnh bằng phương pháp và quy trình chuẩn. Các cặp mồi (primers) phù hợp có nguồn gốc từ chuỗi gen K13 được sử dụng để khuếch đại Kelch 13 đủ để đọc khung mở với việc áp dụng một quy trình kỹ thuật Nested PCR để mô tả trình tự hoàn chỉnh từ acid amin 210 trở đi (phần bảo tồn của các protein) và coi những kết quả dị hợp tử là đột biến.
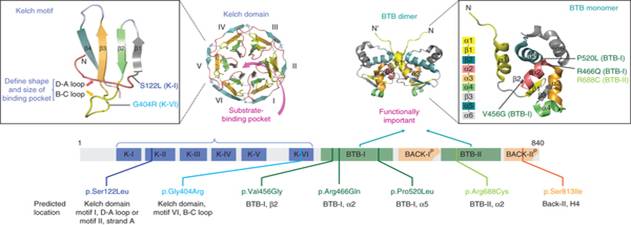
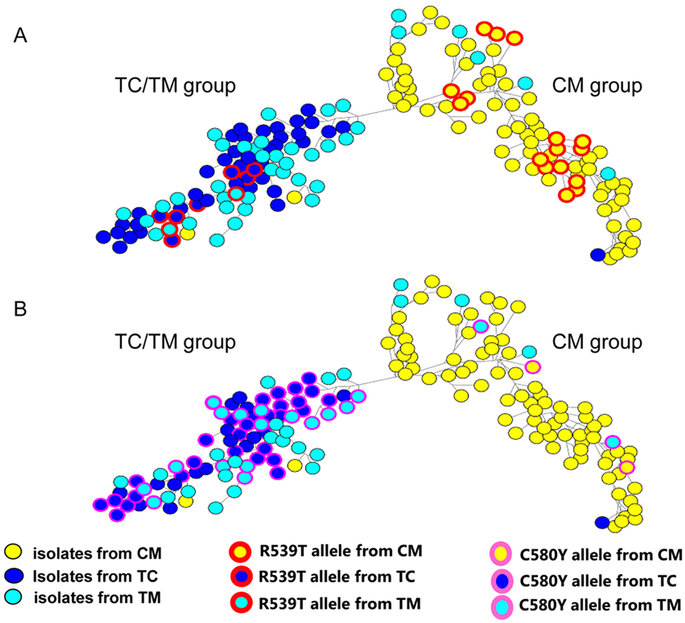
Kết quả số liệu cho thấy trong số 2.378 mẫu xét nghiệm, có 940 (40%) mẫu tạo ra trình tự rõ ràng bao gồm các acid amin 210-726 của gen K13. Tỷ lệ thành công chiết tách DNA và giải trình tự tổng thể là 97% cho toàn bộ mẫu máu, 84% trên các vết máu khô trên giấy thấm và 26% trên các mẫu que thử xét nghiệm chẩn đoán nhanh (RDTs). Không sàng lọc mẫu với PCR trước khi thử để giải trình tự K13. Trình tự của 11/12 mẫu từ cả hai xét nghiệm máu giêm sa và chẩn đoán nhanh cho thấy trình tự phù hợp, các mẫu còn lại không tạo ra trình tự từ các thử nghiệm chẩn đoán. Chỉ có năm kiểu gen hỗn hợp là rõ ràng trong đọc trình tự. Đã xác định được 29 loại đột biến khác nhau sau acid amin 210, trong đó có 26 (90%) là vị trí sau acid amin 440. Có 371 mẫu (39%) được phân lập có vùng propeller đột biến. Kết quả này phù hợp với các nghiên cứu trước đó, cho thấy những đột biến này tập trung ở phần lưỡi 1-4 của propeller. 17 mẫu được phân lập có một đột biến E252Q trong phần thân và gọi là các protein K13, không có mẫu nào có nhiều hơn một đột biến trong các vùng bảo tồn của protein. Loại đột biến F446I đã xác định trong 80 mẫu ở sáu tiểu vùng hoặc khu vực với một số khu vực vùng thượng của Myanmar cho thấy tỷ lệ nhiễm vượt quá 10%; 21 mẫu (47%) trong 45 mẫu thu được ở Homalin, vùng Sagaing (cách xa 25 km từ biên giới Ấn Độ) có đột biến propeller K13 (chủ yếu là các đột biến F446I). Các đột biến P574L cũng được xác định trong 41 mẫu ở bảy bang hoặc khu vực, các đột biến A676D chỉ xác định ở trong ba tiểu bang hoặc khu vực phía bắc Myanmar. Các đột biến C580Y, xác định ở mức cao phổ biến ở miền tây Campuchia, 4 đột biến chỉ giới hạn ở bang Kayin và cũng đã xuất hiện với tỷ lệ cao ở tỉnh Tak liền kề phía tây của Thái Lan biên giới. Đáng chú ý là các đột biến M476I, thể hiện sự phát triển sau khi kháng chọn lọc với artemisinin trên in vitro kéo dài thêm đã được xác định trong 18 mẫu phân lập.
Khoảng hai phần ba các đột biến K13 được xác định được mô tả trước đây ở Myanmar hoặc tại biên giới Myanmar-Thái Lan và một nhóm nhỏ cũng đã được ghi nhận ở Campuchia. Những đột biến xác định trước đây có xu hướng phổ biến cao hơn những mẫu ở Myanmar, không mẫu nào trong số này được xác định trong hơn 10 mẫu được phân lập. Đã xác định được ba đột biến hiếm gặp (ba mẫu hoặc ít hơn) giống trình tự sau acid amin 210 trong số 759 mẫu từ Myanmar. Tính toán hệ số của tiến hóa trong một loài cho các giá trị từ 0,0123 cho dS và 0,0136 cho dN. Suy luận áp lực của chọn lọc từ các kết quả trong một loài dN cho tỷ lệ dS của 1,10 là thách thức, nhưng kết quả này là tương thích mạnh với các chọn lọc kháng đã ghi nhận. Tỷ lệ đột biến propeller K13 cho mỗi khu vực là tỷ lệ mẫu có bất kỳ đột biến vị trí sau acid amin 440. Nhập các số liệu thu được vào bản đồ cho thấy một khu vực rộng lớn có tỷ lệ đột biến khá cao (hơn 10%) kéo dài từ vùng đông nam đến phía bắc Myanmar. Phần lớn ở miền hạ Myanmar, các bang Rakhine và Chin ở phía tây có một tỷ lệ đột biến K13 rất thấp và điều này phù hợp với sự vắng mặt của đột biến K13 ở ký sinh trùng vùng cận với quốc gia Bangladesh. Phát hiện trong nghiên cứu này cung cấp bằng chứng chắc chắn rằng loài P. falciparum kháng artemisinin kéo dài và lan rộng khắp trên miền thượng Myanmar, bao gồm cả các khu vực biên giới ở phía tây bắc gần với Ấn Độ. So sánh với vùng hạ Myanmar và các bang phía tây (bang Rakhine và Chin) hiện đang có một tỷ lệ đột biến K13 tương đối thấp và không có bằng chứng về sự lây lan vào phía đông nam Bangladesh. Cũng không có bằng chứng cho thấy kháng artemisinin đã lan đến Ấn Độ, song rất ít dữ liệu có sẵn để đưa ra kết luận.
Kháng artemisinin đã được phát hiện ở phía tây Campuchia hơn một thập kỷ trước. Các nghiên cứu về quần thể di truyền học đã mô tả quần thể P. falciparum với sự biến đổi gen tạo nguy cơ tiềm ẩn lan truyền tăng lên mức khá cao, mỗi quần thể được liên kết với các đột biến K13 cụ thể và có mức độ kháng artemisinin cao cả trên in vivo và in vitro. Bảy đột biến riêng biệt dường như đã phát sinh độc lập nhiều hơn một lần tại các vị trí khác nhau, những đột biến bao gồm C580Y, được định hình và lan rộng đến các khu vực khác. Trong nghiên cứu này, các tác giả cũng tìm thấy ký sinh trùng có đột biến C580Y duy nhất ở biên giới Myanmar-Thái Lan, mặc dù dòng/ chủng này dường như được tách ra từ dòng/ chủng ở Campuchia. Rất ít các đột biến K13 ở Myanmar hiện nay được báo cáo có tỷ lệ cao ở Campuchia. Hơn nữa, các đột biến ở Myanmar dường như thuộc nhóm hướng về vùng Kelch đầu tiên (acid amin 441-475) với một đột biến trong vùng thân được bảo tồn của protein (E252Q) cũng chiếm tần suất đáng kể ở phía đông nam Myanmar. Ở phía bắc Myanmar, kể cả vùng rất gần biên giới Ấn Độ, tỷ lệ F446I đột biến rất cao. Tại sao có những dạng khác nhau của các đột biến tại các vị trí khác nhau là chưa rõ ràng, có thể giải thích có thể là Myanmar ở giai đoạn sớm của một quá trình tiến hóa hơn so với Campuchia trên quần thể ký sinh trùng. Việc lan rộng đột biến ở Myanmar ở một mức độ giảm của kháng artemisinin (mặc dù đột biến P574L lan rộng dường như gắn với sự làm sạch KSTSR mà ít nhất là làm chậm sạch như đột biến C580Y) hoặc có thể có một giá trị vừa phải, để chúng cạnh tranh bằng lựa chọn thay thế phù hợp theo thời gian như C580Y. Ngoài ra, có thể có áp lực chọn lọc thuốc đặc biệt do sử dụng thuốc chống sốt rét khác nhau trong vùng rộng lớn và thời gian kéo dài, di truyền của vật chủ, hoặc đặc tính sinh học của muỗi thúc đẩy sự khác biệt các đột biến ở hai khu vực. Cần những nghiên cứu phù hợp sâu hơn về ký sinh trùng, độ nhạy cảm trên các thử nghiệm in vitro của thuốc có khả năng làm sáng tỏ những vần đề này.
Nghiên cứu này cho thấy có giá trị của khâu giám sát dịch tễ học phân tử có thể được thực hiện với các xét nghiệm chẩn đoán nhanh (và với vết máu khô trên giấy thấm) một cahcs hệ thống nếu có được những xét nghiệm và gửi đến phòng thí nghiệm tham chiếu. Hai không gian mô hình địa lý có thể cung cấp thông tin phù hợp và kiến thức được cập nhật kịp thời về mức độ kháng artemisinin ở Myanmar và có thể được ưu tiên sử dụng để hướng dẫn các biện pháp can thiệp. Bổ sung các dữ liệu cần thiết để làm giảm sự không chắc chắn của các ước tính hiện tại về kháng thuốc tại các địa phương, có khả năng hướng dẫn bởi một mô hình giám sát mới. Sự lây lan toàn cầu của P. falciparum kháng chloroquin dẫn đến tử vong hàng triệu sinh mạng ở châu Phi và Myanmar là một nơi có chứa ký sinh trùng kháng artemisinin đáng lưu ý. Những dữ liệu này nhấn mạnh mối quan tâm là kháng artemisinin có thể theo những con đường của sự lây lan trong lịch sử của kháng thuốc chống sốt rét từ Đông Nam Á, đi qua Myanmar đến Ấn Độ và rồi lan rộng sang các quốc gia châu Phi. Hơn nữa, sự gia tăng đáng kể dân di cư và du lịch quốc tế có thể trực tiếp thúc đẩy sự lây lan của kháng artemisinin do P. falciparum. Gần đây, các số liệu nghiên cứu kháng thuốc artemisinin có thể đảo ngược xu hướng giảm tỷ lệ mắc và tử vong do sốt rét. Kiến thức về mức độ đột biến propeller K13 cung cấp toàn bộ mức độ kháng artemisinin, nhưng không phải chính nó cung cấp thông tin trực tiếp về hiệu quả của loại thuốc điều trị ACTs đầu tiên artemether-lumefantrin. Giảm hiệu quả của phương pháp điều trị kết hợp artemisinin này, đại diện cho sự kết hợp của artemisinin sự đề kháng và thất bại điều trị của thuốc đồng tác dụng hay thuocs đi kèm (mefloquin) là một vấn đề cấp bách ở biên giới phía đông Myanmar, theo quan điểm của kháng chéo giữa mefloquine và lumefantrin, hiệu quả trong các khu vực đó có lẽ thấp. Trong các khu vực khác, nơi KSTSR có đột biến K13 đang phổ biến dự báo về hiệu quả là rất khó và nghiên cứu phương pháp điều trị hiệu quả để xác định liệu một kết hợp khi bắt đầu thất bại và đo lường số lượng bản sao của pfmdr1 trong những mẫu cũng sẽ hữu ích trong khía cạnh này.
Kháng artemisinin đã không được kiểm soát vì hiện tại phương pháp điều trị kết hợp artemisinin đang thất bại trong khu vực bị ảnh hưởng bởi sức đề kháng thuốc artemisinin và có một thực tế về mối đe dọa là tỷ lệ P. falciparum bắt đầu tăng trở lại, nên làm đảo lộn chiến lược loại trừ sốt rét trong khu vực. Ngay cả số lượng thấp của sự bùng nổ trở lại của bệnh thúc đẩy sự xuất hiện và lây lan của kháng thuốc cho các thuốc phối hợp, rút ngắn đáng kể thời gian lưu hành của nhiều thuốc phối hợp artemisinin. Chuyển sang một loại thuốc phối hợp thay thế (như piperaquin), cải thiện hiệu quả của liệu pháp kết hợp artemisinin thành công ở phía tây Campuchia, nhưng chỉ là tạm thời. Những cân nhắc này cho thấy việc hướng dẫn điều trị sốt rét cần phải được chỉnh sửa cập nhật. Sử dụng phác đồ điều trị với thời gian hơn 3 ngày, hoặc có chứa nhiều hơn một thuốc phối hợp sẽ là cần thiết trên một khu vực rộng lớn của Đông Nam Á. Tốc độ mà tại đó phạm vi địa lý của kháng artemisinin đang lan rộng nhanh hơn tốc độ kiểm soát và loại trừ của các biện pháp đang được thiết lập hoặc loại thuốc mới được giới thiệu.
Hiểu sâu ký sinh trùng sốt rét kháng thuốc - Nền tảng khoa học của y tế dự phòng
Kháng thuốc là vấn đề di truyền cơ bản xảy ra trong hầu hết trường hợp điều trị ký sinh trùng sốt rét (KSTSR) và phụ thuộc nhiều vào hiệu lực thuốc, nên sự phát triển và lây lan của P. falciparum kháng thuốc với những loại thuốc này là không thể tránh khỏi. Vai trò của di truyền học là để hiểu được tương tác giữa KSTSR kháng thuốc và chiến lược phát triển các loại thuốc mới để khống chế và trì hoãn tình trạng kháng thuốc. Sử dụng thuốc hợp lý có thể kéo dài thời gian thuốc còn hiệu lực của mỗi loại thuốc (hay duy trì tuổi thọ) trước khi các loại thuốc cũ được loại bỏ và các loại thuốc mới có hiệu quả hơn được thay thế. Trong trường hợp này, các nghiên cứu khoa học cơ bản về ký sinh trùng có tác động lớn đến quyết định sức khỏe cộng đồng về điều trị bệnh nhân, phát triển các loại thuốc mới áp dụng các phương pháp hiện đại để hiểu biết về lý do tại sao KSRST phát triển kháng và nghiên cứu sử dụng KSTSR P. falciparum để tìm hiểu quá trình kháng thuốc.
Sử dụng chủng P. falciparum làm mẫu thử nghiệm vì nó là một tác nhân lây nhiễm lan rộng và có khả năng gây tử vong cho con người đã được nghiên cứu sâu qua 100 năm nay. Việc áp dụng các phương pháp phân tử để nghiên cứu chủng P. falciparum song song với việc phát triển kỹ thuật này trong những năm 1990 và xu hướng này đã phát triển mạnh cùng các phương pháp nghiên cứu về gen. Dùng phương pháp phân tử để phân tích chủng P. falciparum kháng thuốc thông qua 3 yếu tố:
-Sốt rét thường được chẩn đoán bằng cách chích máu đầu ngón tay và soi lam máu dưới kính hiển vi để xác định số lượng KSTSR trong máu bệnh nhân. Tiếp theo, một lượng nhỏ máu bị nhiễm KSTSR được thu thập vào mẫu giấy thấm để cung cấp lượng lớn chất liệu di truyền DNA của ký sinh trùng P. falciparum và đảm bảo một nguồn ổn định dài hạn của KSTSR được phân lập để phân tích;
-Sự phát triển các phương pháp để tinh sạch DNA và khuếch đại PCR từ các mẫu này cho phép xác định nhanh những thay đổi về di truyền và các kỹ thuật này đã trở thành thường qui trong nhiều phòng thí nghiệm trên toàn thế giới;
-Rất nhiều gen mã hóa và các chức năng cơ bản của tế bào trong P. falciparum được bảo tồn đáng kể, tính đa hình nucleotide sợi đơn (SNPs) trong các gen liên quan đến kháng thuốc hầu như luôn có liên quan đến kiểu hình được quan sát và không bị che lấp bởi tính đa hình trong vị trí các codon, loại không góp phần vào đề kháng thuốc.
Bệnh sốt rét đã được điều trị từ hàng trăm, thậm chí hàng ngàn năm, bắt đầu với thuốc cổ điển Thanh hao hoa vàng của y học cổ truyền Trung Quốc và quinin trong thế kỷ 17, nhưng thuốc chống sốt rét được sản xuất và sử dụng rộng rãi đầu tiên là chloroquin. Nó được dùng phổ biến và rộng rãi sau Chiến tranh thế giới thứ hai và được sử dụng để điều trị hàng trăm triệu bệnh nhân sốt rét. Trong giai đoạn đầu, thước đo hiệu quả duy nhất của thuốc là đánh giá các triệu chứng của bệnh nhân sau khi điều trị được cải thiện như thế nào. Đến năm 1957, các nhà khoa học đã ghi nhận thất bại trong điều trị với phác đồ điều trị chuẩn trên một số bệnh nhân, đầu tiên ở Đông Nam Á và châu Mỹ Latinh, vào cuối năm 1980 cho thấy thuốc đáp ứng kém đã lan khắp châu Phi. Trong lĩnh vực sức khỏe cộng đồng, hiệu quả điều trị sốt rét được đánh giá theo hướng dẫn hay đề cương được cập nhật thường xuyên bởi TCYTTG. Việc đánh giá tốn nhiều thời gian và tiền bạc: điều trị bệnh nhân mất ít nhất 28 ngày theo dõi để đảm bảo tất cả các triệu chứng đã được giải quyết và đã sạch ký sinh trùng trong máu bệnh nhân. Dựa vào khuyến cáo của TCYTTG, cơ quan y tế tại mỗi quốc gia đánh giá sự thành công trong điều trị sốt rét dựa trên tỷ lệ bệnh nhân được điều trị khỏi với loại thuốc đó.
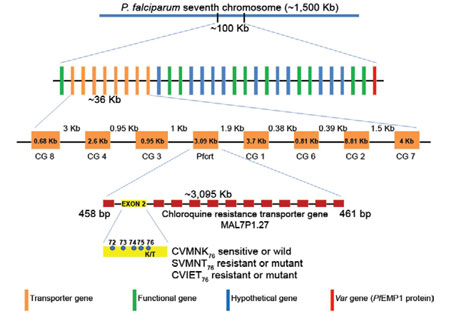
Từ các quan điểm trên về sức khỏe cộng đồng, xu hướng giảm thành công trong điều trị là những yếu tố quan trọng, trong đó kháng với một loại thuốc là một vấn đề ngày càng được quan tâm. TCYTTG hướng dẫn thiết lập một hiệu quả điều trị trên 90% mà một loại thuốc thay thế nên được khuyến khích. Thử nghiệm trên người luôn là vấn đề khó khăn, do đó các phương pháp thử nghiệm bổ sung làm tăng thêm các thông tin thu được từ thử nghiệm trên người luôn được quan tâm phát triển. Xác định sự thay đổi phân tử trong ký sinh trùng có liên quan tới điều trị thất bại bằng chloroquin chỉ có thể được thực hiện sau khi xây dựng các phương pháp thích hợp để nuôi chủng P. falciparum trong phòng thí nghiệm và phát triển các phương pháp đánh giá dược lực học của thuốc trên thử nghiệm in vitro. Đây là một tiến bộ quan trọng và P. falciparum là một ký sinh trùng có thể được nghiên cứu trong phòng thí nghiệm. Xác định sự thay đổi di truyền có tính kháng với chloroquin, hiệu quả và phân tích chi tiết về di truyền giữa đáp ứng ký sinh trùng và kháng với chloroquin cần một bước đột phá. Phân tích phân tử xác định chi tiết về tính đa hình nucleotide sợi đơn SNPs, làm thay đổi các mã khóa acid amin vận chuyển kháng chloroquin (CRTS) được mã hóa bởi các gen pfcrt (PF3D7_0709000) trong P. falciparum. Sự liên kết này được hỗ trợ mạnh mẽ bởi sự tương quan giữa các chỉ điểm ứng với pfcrt của ký sinh trùng nhạy cảm với chloroquin trong các nghiên cứu phòng thí nghiệm. Giá trị thực tiễn của nghiên cứu phòng thí nghiệm dựa trên thông tin đã được xác nhận khi các nhóm làm việc trong lĩnh vực phát triển phương pháp sinh học phân tử cơ bản enzyme phân cắt giới hạn RFLP dựa trên sợi đơn phân tử chứng minh bệnh nhân bị nhiễm KSTSR mang alen pfcrt 76T kháng thuốc có khả năng thất bại trong điều trị bằng chloroquin nhiều hơn những người mang KSTSR có một alen K76 nhạy. Nhiều nhóm nghiên cứu phân lập SNPs từ các vùng khác nhau đã quan sát thấy ở những gen pfcrt, có hơn một alen kháng thuốc được xác định. Các alen kháng thuốc phổ biến nhất mang một kiểu sợi đơn với thay thế giữa vị trí codon72 và codon76, thường được mã hóa các acid amin CVIET hoặc SVMNT, nhưng quan trọng nhất là các đột biến K76T trong pfcrt được tìm thấy trong tất cả các chủng kháng chloroquin từ một loạt các địa điểm mà được nghiên cứu trên toàn thế giới.

Tiếp tục phân tích phân tử chứng minh một gen thứ hai đã được biết đến của P. falciparum gắn liền với đáp ứng chloroquin, gen đa kháng thuốc 1 (PF3D7_0523000), pfmdr1. Một lần nữa, nghiên cứu trên in vitro và các mối tương quan phân tử liên kết đa hình trong pfmdr1 cũng như các kiểu sợi đơn pfcrt 72-76 đến việc kháng amodiaquin – loại thuốc chống sốt rét tương tự chloroquin và tăng số lượng bản sao của gen kháng với mefloquin và lumefantrin (hai thuốc sốt rét khác).
Liên quan đến các chỉ điểm phân tử kháng với các antifolate, thuốc pyrimethamine được sản xuất dưới tên biệt dược Daraprim, nghiên cứu này được công ty Burroughs Wellcome tiến hành vào năm 1950. Trong cùng thời gian, Gertrude Elion và George Hitchings chứng minh tác động của nhóm thuốc này là chất ức chế cạnh tranh với một enzym quan trọng trong tổng hợp acid nucleic, khử dihydrofolate reductase và pyrimethamine ức chế chủ động một số loài KSTSR. Tuy nhiên, trong các nghiên cứu đầu tiên ở Đông Phi của tác giả David Clyde cho thấy hiệu quả/ hiệu lực của pyrimethamin giảm nhanh chóng chỉ trong vòng 6 tháng khi sử dụng một mình pyrimethamin để dự phòng. Greenberg và Richeson đã phát hiện sulfadoxine có tác dụng hiệp đồng làm tăng tác dụng chống ký sinh trùng của pyrimethamine và sau đó, Brown chứng minh sulfadoxine ức chế một enzym khác trong sinh tổng hợp folate, dihydropteroate synthase. Cuối cùng, ứng dụng tác dụng hiệp đồng giữa hai hoạt chất vào mục đích làm chậm lại sự đề kháng thuốc của ký sinh trùng, pyrimethamine kết hợp với sulfadoxine (SP) với tên biệt dược Fansidar được đưa vào điều trị.
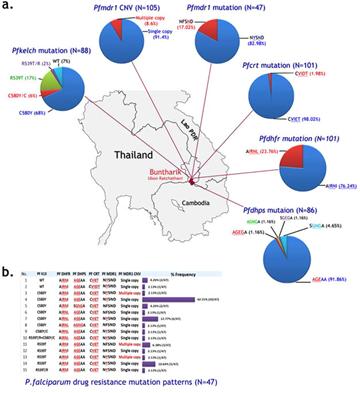
Những nghiên cứu sinh hóa cơ bản cung cấp thông tin cho mục tiêu điều trị của mỗi loại thuốc và cho phép xác định các đột biến, đặc biệt trong P. falciparum ở vùng dihydrofolate reductase của gen dihydrofolate reductase-thymidylate synthase, pfdhfr (PF3D7_0417200) và gen dihydropteroate synthase, pfdhps (PF3D7_0810800) làm giảm tính nhạy của P. falciparum đối với pyrimethamin và nhóm thuốc sulfamide tương ứng. Trong cùng thời gian, phương pháp phân tử đơn giản cũng được thiết lập cho phép đánh giá SNPs có liên quan đến pfdhfr và gen pfdhps bằng cách sử dụng những mẫu máu thu thập được từ nghiên cứu thực địa. Những phương pháp này được áp dụng một cách nhanh chóng để đánh giá mức phổ biến của alen gắn liền với kháng thuốc SP.
Cũng như chloroquin, liên quan đến các phân tử làm thay đổi hiệu lực thuốc đã được xác nhận qua phân tích KSTSR đáp ứng với mỗi loại thuốc trong phòng thí nghiệm và tương quan với hiệu quả điều trị ở những bệnh nhân được điều trị bằng SP. Cuối cùng, ký sinh trùng có mang một một alen pfdhfr với 3 đột biến (trong codon N51I/C59R/S108N) và một alen pfdhps với 2 đột biến (A437G/K540E), xem như là kiểu gen đột biến gấp 5 lần hoàn thành một chu kỳ, có liên quan chặt chẽ với tình trạng thất bại điều trị. Phương pháp phân tích và kỹ thuật phân tử này đã được áp dụng cho các bệnh nhân bị nhiễm ký sinh trùng mang alen kháng thuốc loại pfcrt 76T có nhiều khả năng thất bại trong điều trị bằng chloroquin hơn những người có ký sinh trùng mang một alen K76 nhạy. Vấn đề quan trọng đặt ra là có sự hiện diện của KSTSR kháng thuốc trong lần lây nhiễm ban đầu được sử dụng để dự đoán xem bệnh nhân đó chắc chắn sẽ thất bại trong điều trị? Câu trả lời là không, vì trên thực tế rằng nhiều bệnh nhân có ký sinh trùng kháng được điều trị khỏi hoàn toàn và vì họ đã phát triển khả năng miễn dịch một phần từ lần nhiễm trùng trước đó, nên hệ thống miễn dịch của họ thường làm sạch KSTSR, bao gồm cả những trường hợp đã kháng với chloroquin. Kết quả là khi một ký sinh trùng gây bệnh đã kháng với thuốc, một số bệnh nhân, đặc biệt là người lớn trong khu vực có sự lây truyền mạnh, khi bị nhiễm đã được chữa khỏi. Những nghiên cứu được thực hiện ở các địa điểm khác nhau, cho thấy rõ ràng rằng sự lan truyền của một kiểu gen kháng thuốc trong quần thể KSTSR có thể dự đoán khả năng chung mà bệnh nhân từ các khu vực đó sẽ được chữa khỏi. Tuy nhiên, vì mối quan hệ giữa các chỉ điểm phân tử và kết quả điều trị là gián tiếp, tiềm năng của phương pháp này áp dụng trong lĩnh vực sức khoẻ cộng đồng rất khó áp dụng. Những công cụ này còn thúc đẩy phân tích hồi cứu ở những địa điểm nghiên cứu dài hạn nơi mà tỷ lệ chỉ điểm phân tử có mối tương quan với kết quả điều trị lâm sàng và xu hướng đáp ứng trên in vitro của ký sinh trùng. Tổng hợp những đánh giá xác nhận việc sử dụng sinh học phân tử trong phòng thí nghiệm dựa vào ký sinh trùng để cung cấp các bằng chứng có giá trị để hỗ trợ thiết thực và khuyến nghị về việc sử dụng thuốc chống sốt rét có hiệu quả cho biết khả năng nhận dạng KSTSR mang các chỉ điểm phân tử được xác định đã mở ra một hướng mới để áp dụng các phân tích phân tử để đo lường sự phân bố của mỗi chỉ điểm hay marker, trong các mẫu thử lấy từ bệnh nhân hoặc trong điều tra sàng lọc cộng đồng. Hàng trăm tài liệu về mức độ nhiễm trên toàn thế giới của các alen có liên quan tới khả năng kháng chloroquin, SP, amodiaquin và mefloquin trong 4 locus được xác định (pfdhfr, pfdhps, pfcrt và pfmdr1) đã được mô tả từ năm 2000. Các tài liệu này được xem xét và cập nhật thường xuyên bởi TCYTTG và cung cấp các thông tin được sử dụng để đưa ra các quyết định cho sức khoẻ cộng đồng. Đánh giá về tác động đến sức khỏe cộng đồng do kháng thuốc sốt rét xảy ra, cả chloroquin và SP đã bị loại bỏ khỏi danh mục thuốc sốt rét thiết yếu ở khu vực Đông Nam Á trong những năm 1970 và 1980 và ở nhiều nơi đã được thay thế các thuốc này bằng loại mefloquin, nhưng chloroquin vẫn là thuốc sốt rét chính ở châu Phi vào đầu những năm 2000. Cuối những năm 1990, hai nghiên cứu đã chứng minh tỷ lệ tử vong do sốt rét ở trẻ em người Senegal tăng từ 2-5,5 lần, cũng trong khoảng thời gian này khi nghiên cứu về phân tử trong phòng thí nghiệm cho thấy KSTSR kháng chloroquin ngày càng phổ biến.
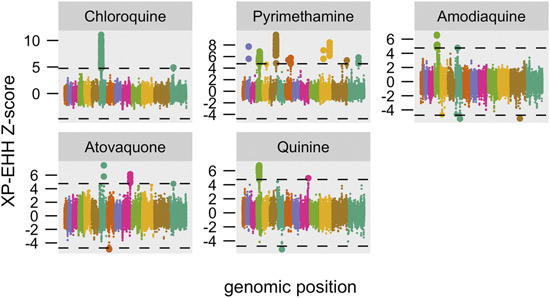
Tổng số người chết do sốt rét ít bị ảnh hưởng, vì nhiều người lớn bị nhiễm không biểu hiện các triệu chứng bệnh hoặc họ ít có tiếp cận nhu cầu điều trị thuốc. Mặc dù có những cảnh báo, nhiều nước vẫn tiếp tục sử dụng chloroquin trong một thời gian dài sau khi hiệu quả của nó đã giảm thấp, đặc biệt là ở trẻ nhỏ, nhóm có nguy cơ cao bởi bệnh sốt rét. Trong những năm đầu của thập niên 2000 một sự thay thế SP được thực hiện ở một số nước, nhưng hiệu quả của nó đã nhanh chóng bị giảm thấp do sức đề kháng thuốc, đặc biệt là ở Đông và Nam châu Phi. Các chỉ điểm phân tử đóng vai trò như các công cụ điều tra và nghiên cứu dịch tễ học sốt rét. Thật vậy, để hiểu được quá trình kháng thuốc và tiến hóa của nó như thế nào, điều quan trọng nhất là xác định được nguồn gốc của các alen kháng thuốc. Có phải chúng phát sinh lặp đi lặp lại ở nhiều nơi, hoặc chỉ trong một vài ổ và sau đó lan rộng đến nơi khác? Câu hỏi này đã được trả lời cho chloroquin và thuốc SP trong một loạt các tài liệu nghiên cứu về tính đa hình cao của các vệ tinh nằm bên sườn các vùng mã hóa của các alen liên quan tới kháng thuốc ở Nam Mỹ, các vệ tinh cho thấy alen đặc trưng của cả pfcrt và pfdhfr đã phát triển tại chỗ và những alen này đã lan rộng đến các châu lục bất cứ khi nào các thuốc lựa chọn được sử dụng mạnh mẽ, các tác giả cho rằng có thể có một nguồn gốc duy nhất của các alen kháng.
Trong các chủng ở châu Phi, các alen kháng phổ biến nhất của pfcrt mã hóa các acid amin, CVIET trong codon 72-76, các alen kháng pyrimethamin cao đột biến gấp ba của pfdhfr, mã hóa các acid amin 51I, 59R, 108N. Một trong các alen đã lan rộng ở châu Phi và mỗi alen đó mang một mẫu vệ tinh hiển thị gần như bất biến và tiến hóa của kháng là một điều hiếm có. Bất ngờ lớn nhất không phải của các alen có nguồn gốc ở châu Phi. Thay vào đó, từng là một thế hệ tiếp sau của một alen kháng chloroquin hoặc SP có nguồn gốc ở khu vực Đông Nam Á! Mỗi alen đã được đưa vào Đông Phi, có lẽ bởi du khách không có triệu chứng hoặc những người nhập cư từ một khu vực ở châu Á, nơi các alen kháng đã có mặt trong nhiều thập kỷ, sau đó lan truyền trong khoảng thời gian một thập kỷ bởi di biến động dân của người bị nhiễm bệnh trên toàn châu Phi. Nghiên cứu hồi cứu các mẫu từ các khu vực nghiên cứu ở Senegal và ven biển Kenya cho thấy các alen pfdhfr nhập khẩu đã có mặt ở mức rất thấp, thậm chí trước khi SP được sử dụng trong các khu vực đó. Tuy nhiên, ngay sau khi tăng sử dụng thuốc, mức lan rộng của các alen kháng tăng cực kỳ nhanh chóng trong một vài năm và cuối cùng được xác định lan rộng toàn châu lục. Với các mô hình tương đối đơn giản, một loạt các alen của pfdhps và pfmdr1 được quan sát thấy trong các vùng ở châu Phi và những alen này đã phát sinh và lây lan xa hơn tại địa phương. Nhìn chung, các nghiên cứu này đã chứng minh rằng các chỉ điểm phân tử có thể được sử dụng để xác định một cách nhanh chóng các vùng có ký sinh trùng sốt rét kháng thuốc, tiên đoán nguồn gốc của chúng và tìm theo những hướng phát triển kháng theo hướng phân tích thời gian và không gian địa lý. Sự lây lan trên phạm vi rộng của KSTSR kháng thuốc cũng nâng cao nhận thức rằng KSTSR kháng thuốc có thể lây lan tại chỗ nhưng cũng có khả năng lan rộng khắp lục địa.
Hứa hẹn của liệu pháp thuốc phối hợp có thành phần artemisinin (ACTs)
Cuối những năm 1990, một đề xuất dựa trên các kết quả được sử dụng thuốc điều trị bệnh lao và HIV, lựa chọn thiết kế để làm thế nào chậm lại tiến trình kháng thuốc gây ra do KSTSR kháng thuốc. Các loại thuốc kết hợp có thành phần artemisinin có thời gian bán thải ngắn nhưng tác dụng nhanh, kết hợp với một trong số các hoạt chất chống sốt rét có hiệu quả tác dụng kéo dài, thường gọi là ACTs. Thực tế, khi hiệu lực của mefloquin bị suy giảm ở các vùng sốt rét tại Thái Lan, artesunate và các dẫn xuất artemisinin được bổ sung vào danh mục thuốc sốt rét thiết yếu đã cải thiện rõ rệt hiệu quả điều trị. Phương pháp này được đề xuất và một số thuốc ACTs với các hoạt chất hiệp đồng tác dụng khác nhau được phát triển. Việc áp dụng các thuốc ACTs trong điều trị sốt rét được TCYTTG khuyến khích vào đầu năm 2006, nhưng những thay đổi trong chính sách thuốc quốc gia là rất khó khăn và thực tế việc sử dụng phổ biến ACTs không nhiều. Tuy nhiên, khi sử dụng ACTs tăng lên đã góp phần quan trọng trong việc giảm mắc và giảm chết do sốt rét trong thập niên qua và vẫn còn hiệu quả trên lâm sàng ở hầu hết các khu vực trên thế giới. Cơ chế tác dụng của ACTs là nhờ artemisinin/ hoặc dẫn suất sẽ làm giảm nhanh dung khối KSTSR trong máu, từ đó giảm nhanh các triệu chứng và thuốc đồng tác dụng sẽ còn hoạt động trong nhiều ngày hoặc nhiều tuần sẽ dọn sạch bất kỳ KSTSR nào còn lại. Tuy nhiên, trong năm 2009, một vấn đề với thuốc ACTs xuất hiện là tốc độ làm sạch ký sinh trùng khi đáp ứng với artemisinin bị chậm lại trên một số bệnh nhân gần khu vực biên giới Thái Lan-Campuchia - là khu vực mà loại thuốc artemisinin bị lạm dụng trong nhiều thập kỷ và cùng một vị trí mà ký sinh trùng sốt rét đã từng kháng với chloroquin và sulfadoxine-pyrimethamine trước đó. Trong một thời gian ngắn, các phương pháp tính thời gian làm sạch ký sinh trùng được chuẩn hóa và tiếp tục nghiên cứu cho thấy sự biến đổi kiểu gen của KSTSR là nguyên nhân chính gây lên kiểu hình chậm làm sạch KSTSR này. Nguy hiểm hơn, sự lan truyền các kiểu gen biến đổi này đang gia tăng tại Campuchia và bắt đầu tăng ở các nước láng giềng, điều đó sẽ là mối đe dọa đến tất cả các thuốc chống sốt rét hiệu quả đang sử dụng trên toàn thế giới có chứa artemisinin và không thể thay thế bằng các thuốc khác. Bài học của sự di cư của chủng KSTSR kháng chloroquin và SP từ châu Á đến châu Phi cho thấy sự cần thiết phải ngăn chặn theo một tiến trình tương tự đối với loại thuốc phối hợp ACTs.
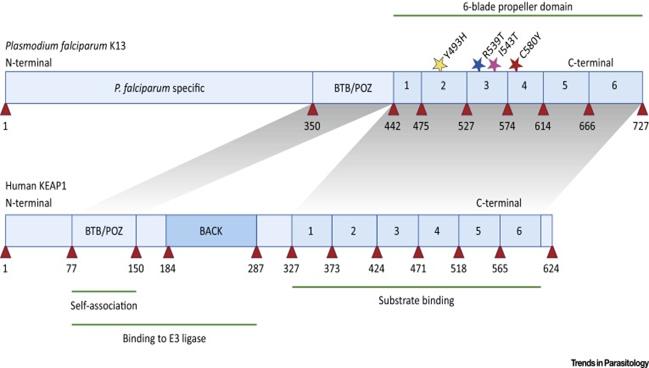
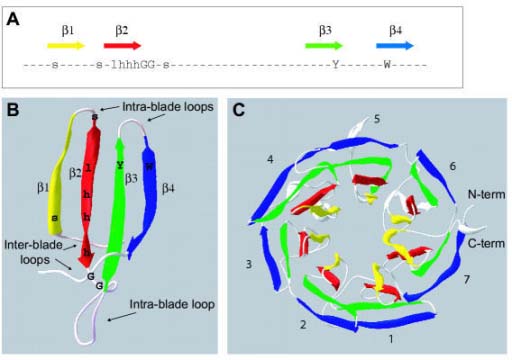
Cũng như nghiên cứu đối với chloroquin và SP, theo dõi kiểu hình kháng thuốc của KSTSR rất khó vì các số liệu chỉ là tốc độ làm sạch KSTSR ở các bệnh nhân và đánh giá rất khó và tốn thời gian. Tuy nhiên, giá trị của một chỉ điểm (marker) di truyền thay đổi đã được đánh giá cao và phương pháp phân tử nhanh chóng được áp dụng. Một bộ gen tham chiếu của loài P. falciparum được công bố rộng rãi từ năm 2002 và các nghiên cứu giải trình tự thế hệ tiếp theo có thể cung cấp thông tin di truyền trên sự đa dạng của KSTSR. Phân tích toàn bộ bộ gen được sử dụng để xác định một vùng Kelch trên nhiễm sắc thể 13 cho thấy bằng chứng về sự liên quan giữa vùng nhiễm sắc thể 13 với việc chậm làm sạch ký sinh trùng là cần thiết. Mặc dù có những cơ sở từ phân tích gen, marker chính xác vẫn chưa được xác định, nên đòi hỏi các ứng dụng khoa học cơ bản như đã sử dụng trước đó đối với chloroquin và SP để xác định một kiểu hình chỉ điểm phân tử liên quan tới sự quá trình chậm làm sạch KSTSR. Hiện nay vẫn còn nhiều vấn đề phải nghiên cứu trước khi xác định một marker phân tử đơn giản với các SNPs như các marker tạo ra kháng với chloroquin và SP. Xác định các locus trong số quần thể KSTSR ở Campuchia (PF3D7_1343700) mã hóa một protein Kelch gọi là K13, một loại trong nhóm lớn protein đã được nghiên cứu và tìm thấy trong nhiều sinh vật, kể cả con người. Những protein này có một bộ sáu nếp beta được gấp lại thành một "vùng cánh quạt" và tất cả KSTSR chậm làm sạch không có nghĩa là có sự thay đổi phân tử trong vùng đó. Các protein trong nhóm Kelch thực hiện chức năng đa dạng, chủ yếu là tham gia vào tổ chức và tương tác với các protein khác. Các giải thích đơn giản nhất của alen K13 đột biến đa dạng là thay thế bất kỳ một trong các acid amin khác nhau trong vùng propeller tương tác đủ để làm giảm chức năng của K13. Một kết quả quan trọng từ nghiên cứu này là một mình gen không cung cấp tất cả thông tin cần thiết, nên xây dựng một phương pháp phân tích trên cơ sở khoa học làm nền tảng cho sự phát triển nhanh chóng tìm ra một marker kháng artemisinin. Các phương pháp tiếp cận kết hợp là cần thiết. Một định nghĩa lâm sàng chính xác của các kiểu hình cần được đưa ra bởi sự kết hợp các nghiên cứu trong phòng thí nghiệm và ứng dụng các phương pháp di truyền hiện đại để giải quyết vấn đề một cách nhanh nhất, nghĩa là đánh giá có sự phối hợp giữa in vivo với các phân tích phân tử. Các marker phân tử liên quan đến kháng chloroquin và SP được xác định quá muộn và nó chỉ được sử dụng để hồi cứu sự thất bại trong điều trị của cả 2 thuốc này. Làm thế nào có thể áp dụng những bài học đó để bảo vệ hiệu quả ACTs càng lâu càng tốt hay nói đúng hơn là kéo dài tuổi thọ của chúng?
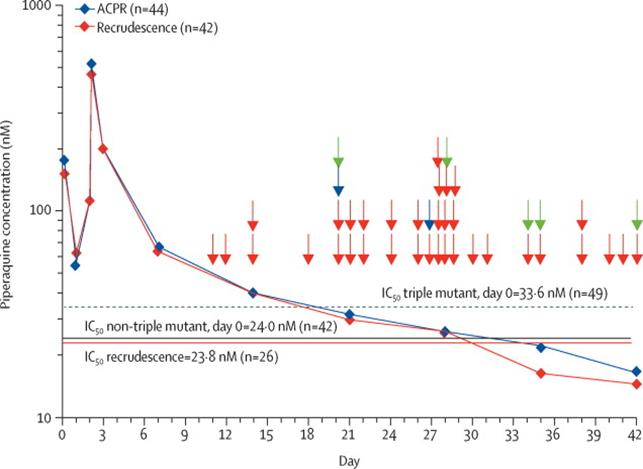
-Tùy điều kiện cụ thể ở một số vùng để xác định các điểm nóng để lựa chọn alen kháng thuốc cao, đặc biệt ở khu vực lan truyền bệnh thấp và lạm dụng thuốc tràn lan, có nguy cơ kháng cao;
-Khi alen kháng thuốc đã tiến hóa, mang bởi những người không có triệu chứng, chúng có thể lây lan ra nhiều vùng mà không bị phát hiện;
-Ngay cả khi KSTSR kháng thuốc đang ở một tỷ lệ rất thấp, cần nhanh chóng đưa ra các loại thuốc phù hợp làm tăng tỷ lệ diệt KSTSR;
-Chờ đến khi KSTSR biểu hiện kháng và thất bại điều trị giảm xuống 90% là quá muộn vì thời điểm đó các KSTSR đã kháng cao với thuốc và thuốc phải được thay thế;
-Phát hiện những dấu hiệu đầu tiên của kháng thuốc là rất quan trọng và kết quả phân tích cơ bản dựa vào sinh học phân tử và phòng thí nghiệm về đáp ứng của KSTSR rất cần thiết;
-Ứng phó tích cực và phối hợp hoạt động kịp thời giữa các ban ngành trong PCSR có thể giúp kéo dài tuổi thọ của thuốc sốt rét.
Việc sử dụng các công cụ phân tử để kéo dài thời gian hiệu lực của ACTs nên chăng? Ngoại trừ khu vực sông Mê Kông, thuốc ACTs vẫn là thuốc chống sốt rét đầu tay có hiệu quả và kiểu hình chậm làm sạch KSTSR được báo cáo đến nay chỉ có ở khu vực sông Mê Kông. Tại Campuchia, ký sinh trùng với đột biến alen K13 mang những thay đổi không đồng nghĩa với những sợi đơn thay đổi khác nhau xuất hiện độc lập nhiều lần trong vùng propeller. Thay vì một sợi đơn alen kháng thuốc trải dài từ một vị trí duy nhất, cũng có thể có nhiều ổ độc lập của kháng. Tất cả kết quả về đột biến K13 cho đến nay đều tập trung vào KSTSR ở khu vực sông Mê Kông, nhưng có thể có những thay đổi phân tử khác làm chậm đáp ứng của KSTSR với artemisinin. Ký sinh trùng từ các vùng sốt rét lưu hành khác nhau liên quan đến chậm làm sạch trên lâm sàng cần được phân tích thận trọng, với các xét nghiệm thể phân liệt và với các nghiên cứu phân tử của propeller K13 để xác định xem liệu các marker như vậy có liên quan chặt chẽ đến sự chậm làm sạch KSTSR trong khu vực sông Mê Kông cũng như xác định KSTSR kháng artemisinin từ các khu vực khác không?
Lan truyền rộng rãi của KSTSR kháng artemisinin hiện đang có mặt không phải là mối đe dọa duy nhất, các khu vực khác có điều kiện tương tự cũng có thể xuất hiện KSTSR kháng thuốc, chẳng hạn vùng lưu hành sốt rét thấp và việc sử dụng artemisinin đơn thuần tràn lan và kéo dài hơn là dạng thuốc kết hợp, cũng là đặc trưng của nhiều quốc gia khác ở châu Á, châu Phi và Mỹ Latin. Hơn nữa, khả năng kháng artemisinin không phải là mối đe dọa duy nhất, hiệu quả của các ACTs phụ thuộc vào cả artemisinin và thuốc đồng tác dụng vẫn còn hiệu lực. Các chỉ điểm phân tử liên quan tới khả năng kháng lumefantrin, amodiaquin, piperaquin và mefloquin đã được xác định. Thay đổi tỷ lệ các marker có thể là một dấu hiệu sớm của lựa chọn thuốc ACTs có chứa chúng. Cảnh báo sớm cho phép thay đổi phù hợp trong sử dụng thuốc gắn kết với làm chậm hoặc thậm chí đảo ngược áp lực chọn lọc.
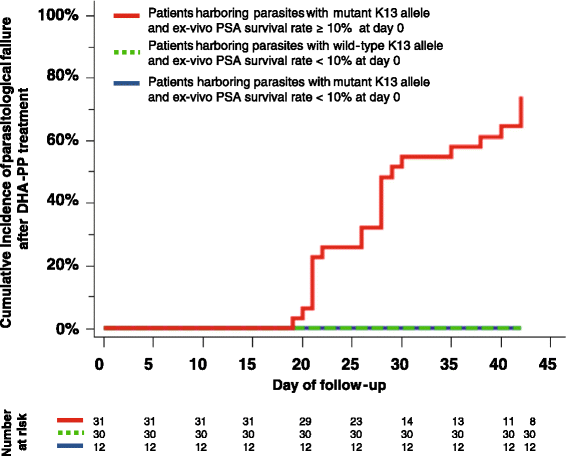
Hiện tại, kháng thuốc đang đe dọa, những công cụ đã sẵn sàng được triển khai trong hệ thống cảnh báo sớm (EWS). Xây dựng mạng lưới giám sát thực địa cho các dấu hiệu sớm của kháng thuốc là một vấn đề quan trọng nhưng cần xác nhận các marker phân tử sớm cho các dẫn suất artemisinin và thuốc đồng tác dụng (parner drug) của chúng và các ứng dụng phân tích bộ gen, sự phối hợp kịp thời và công nghệ thông tin có thể phân tích nhanh chóng dữ liệu từ nhiều vùng miền. Trước khi điều trị thất bại trở nên “phổ biến” thì việc nghiên cứu tiềm năng các phương pháp in vitro hay sinh học phân tử để phát hiện số lượng ký sinh trùng thấp có tín hiệu kháng rất có ý nghĩa. Hiện có các công cụ hiện đại để phát hiện KSTSR kháng thuốc ở mức rất thấp, đủ để quản lý sớm hoặc loại bỏ chúng với các hoạt động phối hợp trong khu vực.
Điểm mấu chốt là kháng thuốc không thể tránh được, nhưng nó có thể được quản lý. Chính sách thuốc hợp lý có thể bảo vệ hiệu quả của các ACTs trong một thời gian rất dài trên khắp thế giới và kháng thuốc phải được quản lý đến khi các loại thuốc mới được phát triển và triển khai có thể đảm bảo hiệu quả của thuốc sốt rét càng lâu càng tốt, điều này là cần thiết cho tương lai.
Sốt rét kháng thuốc có nguy cơ lây lan sang Ấn Độ tạo nên cuộc khủng hoảng y tế toàn cầu
Sốt rét kháng thuốc đang diễn ra nhiều quốc gia trong khu vực tiểu vùng sông Mê Kông và đặc biệt ở khắp các vùng SRLH ở Myanmar và gần đây các báo cáo cho biết đã lan đến biên giới Ấn Độ, rồi Bangladesh và có nguy cơ lan sang các quốc gia châu Phi là điều khó tránh khỏi đối với các thuốc sốt rét thông thường hiện dùng và có thể có nguy cơ không còn hiệu quả trong cuộc chiến toàn cầu chống lại bệnh sốt rét thời gian đến. Các nhà khoa học đang lo ngại rằng nếu không được giải quyết, sốt rét kháng thuốc có thể lây lan trên khắp Ấn Độ và châu Phi, nơi mà số ca sốt rét chiếm 90% các trường hợp mắc bệnh sốt rét trên thế giới, gây ra một cuộc khủng hoảng y tế công cộng. Trong một nghiên cứu được công bố trên tạp chí Lancet, các nhà khoa học đã phát hiện ra kháng artemisinin sau lần đầu tiên được ghi nhận tại Campuchia đã lan rộng đến nam Myanmar. Myanmar là cửa ngõ cho kháng thuốc lây lan sang phần còn lại của thế giới. Vì vậy, nơi đây được coi như tuyến đầu trong cuộc chiến chống lại kháng artemisinin. Hiện tại, các gen đột biến K13 gây kháng thuốc của KSTSR được tìm thấy trong máu của những bệnh nhân sốt rét (BNSR) ở phía bắc và phía đông Myanmar. Các gen đột biến cũng được phát hiện trong khoảng 50% số mẫu thu thập từ những người sống gần biên giới Ấn Độ (chỉ cách 25 km). KSTSR kháng thuốc trong những năm 1960 có nguồn gốc từ Đông Nam Á và từ đó lan qua Myanmar đến Ấn Độ và châu Phi. Các nghiên cứu mới đây cho thấy lịch sử đang lặp lại với KSTSR kháng artemisinin. Do vậy, chúng ta đang phải đối mặt với mối đe dọa sắp xảy ra do kháng thuốc lan rộng đến Ấn Độ, với hàng ngàn sinh mạng bị nguy hiểm, nên rất cần nỗ lực quốc tế hơn để giải quyết vấn đề này ở khu vực biên giới.
Nói tóm lại, hiện nay vấn đề kháng thuốc do ký sinh trùng Plasmodium falciparum với các thuốc sốt rét có hiệu lực cao (artemisinine và dẫn xuất cũng như giảm nhạy với thuốc ACTs) rất phức tạp, không những chúng hình thành và phát triển kháng trên nền có giao lưu biên giới giữa các quốc gia với nhau thông qua các nhóm dân di biến động (MMPs), mà còn xảy ra tại những nơi hoàn toàn không có yếu tố giao lưu biên giới hoặc không có biên giới như ở khu vực miền Trung-Tây Nguyên Việt Nam chẳng hạn là một ví dụ đáng lưu ý. Nghiên cứu tại các điểm theo dõi như thế cho thấy song song có sự tồn tại tỷ lệ ký sinh trùng sốt rét thể vô tính ngày D3 sau khi điều trị là trên 10%, thậm chí có nơi lên đến gần 30-40%, kèm theo phát hiện các đột biến có ý nghĩa liên quan hoặc xác định kháng thuốc theo tiêu chuẩn và chỉ điểm phân tử từ TCYTTG đề nghị trong định nghĩa kháng thuốc. Vần đề hiện nay là làm thế nào trì hoãn kháng và chậm lại tiến trình kháng thuốc đang diễn ra, có thể tìm ra liệu pháp thuốc phối hợp mới có thể dưới dạng ACTs hoặc non-ACTs, hoặc có thể kết hợp trong đó có hơn 3 hoặc hơn loại thuốc như đã đang sử dụng trong các phác đồ chống kháng của bệnh lao và nhiễm HIV/AIDS trên thế giới đang thực hiện.