Việt Nam là một trong những quốc gia trên thế giới được Tổ chức Y tế thế giới (WHO) đánh giá là có tỷ lệ giảm sốt rét tương đối bền vững, trong đó giám sát vector và kiểm soát vector truyền bệnh được đã góp phần quan trọng giảm gánh nặng sốt rét ở Việt Nam.
Việt Nam có tổng diện tích 331,690 km² với chiều dài 4,550 km và tổng dân số là khoảng 88.2 triệu người [177]. Việt Nam có biên giới với Trung Quốc ở phía Bắc, Lào và Campuchia ở phía Tây. Sốt rét là gánh nặng sức khỏe công đồng quan trọng. Dịch sốt rét lớn nhất xảy ra năm 1991 với hơn 1 triệu ca mắc và 4.600 ca tử vong [178]. Sau đợt dịch bệnh này, Chương trình Phòng chống Sốt rét Quốc gia (National Malaria Control Program_NMCP) tập trung vào bệnh sốt rét như y tế công cộng đầu tiên ưu tiên và các hoạt động kiểm soát bệnh mạnh mẽ đã được thực hiện để giúp giảm sự lan truyền bệnh sốt rét, bao gồm cả thuốc điều trị hàng loạt tại các khu vực lưu hành cao, phun tồn lưu hóa chất diệt côn trùng trong nhà và phân phối màn ngủ tẩm hóa chất. Sự thành công của NMCP đã được chứng kiến ở nhiều khu vực, đặc biệt là ở miền Bắc Việt Nam, nơi không có trường hợp mắc bệnh sốt rét xảy ra tại địa phương đã được báo cáo và tỷ lệ muỗi nhiễm KSTSR không được ghi nhận trong nhiều năm [6],[7],[32]. Trong khi kiểm soát bệnh sốt rét đã thành công ở miền bắc Việt Nam thì bệnh sốt rét vẫn tiếp tục là một vấn đề ở phía nam, đặc biệt là ở các khu vực đồi núi có rừng ở miền Trung và Nam
Việt Nam, và khu vực dọc theo biên giới quốc tế với Lào và Campuchia nơi di dân thường xuyên xảy ra [92],[43]. Các dân tộc thiểu số khác nhau là những cộng đồng có nguy cơ mắc sốt rét lớn nhất, đau khổ nhiều hơn 5 lần sốt rét ở đại đa số dân tộc chính ở Việt Nam [179],[180]. Từ năm 2010 đến năm 2011, lần lượt có 36% đến 18% dân số vẫn đang sống ở những khu vực lan truyền sốt rét cao, trong khi 54% đến 20% tiếp xúc với lan truyền thấp và 10-63% nơi không có lan truyền sốt rét xảy ra [2],[3]. Có tất cả 4 loại KSTSR ở người và P. knowlesi đã được báo cáo ở Việt Nam [181],[182],[183]. Báo cáo ca mắc sốt rét hầu hết do P. falciparum (66%) tiếp theo là P. vivax (34%), trong khi P. malariae và P. ovale hiếm khi được ghi nhận [3].
!important; |
Lan truyền Plasmodium knowlesi từ đồng vật sang người đã được báo cáo ở miền Trung và miền Nam [184],[185],[186],[187],[188],[189]. Plasmodium knowlesi đã được tìm thấy ở vector sốt rét chính Việt Nam [181],[183]. Sử dụng hóa chất diệt côn trùng và điều trị thuốc hàng loạt là những biện pháp hiệu quả để kiểm soát các vector và lan truyền sốt rét ở Việt Nam [190]. Tuy nhiên, trong nhiều thập kỷ sử dụng hóa chất diệt côn trùng và thuốc chống sốt rét đã dẫn đến muỗi Anopheles kháng với hóa chất và ký sinh trùng sốt rét kháng thuốc [191],[192],[56],[193],[194]. Hơn nữa, thay đổi sử dụng đất nguyên nhân do phá rừng, mở rộng nông nghiệp, chuyển đổi từ trồng lúa sang nuôi tôm, đã làm thay đổi mạnh mẽ môi trường sống của muỗi và đây là những thách thức mới cho các chiến lược kiểm soát bệnh sốt rét tại Việt Nam. Mặc dù nỗ lực đáng kể đã được đầu tư áp dụng các hoạt động kiểm soát bệnh sốt rét sau dịch năm 1991, nhưng bệnh sốt rét vẫn được xem là một vấn đề y tế cộng đồng quan trọng. Năm 2011, 16.539 trường hợp mắc bệnh sốt rét (6 trường hợp tử vong) đã được báo cáo ở các khu vực miền Trung và Tây Nguyên [195]. Có hai giai đoạn lan truyền bệnh cao nhất trong năm đó là (i) cuối mùa mưa sang đầu mùa khô (tháng 9 đến tháng 1 năm sau) và (ii) từ cuối mùa khô đến đầu mùa mưa (tháng 5 đến- tháng 8). Mùa mưa và mùa khô có thể thay đổi nhỏ từ năm này sang năm khác và cường độ lan truyền sốt rét cũng là phụ thuộc vào khu vực địa lý và các yếu tốkhác.
Thuật ngữ “sốt rét rừng” được định nghĩa trong một tình huống cụ thể của dịch tễ học lan truyền và liên quan đến một vài vector rừng như An. dirus [7],[196],[43],[183]. Dân cư có nghi cơ nhiễm lớn nhất là cộng đồng các vùng đối núi có rừng, đặc biệt là các đồng bào dân tộc thiểu số có mức sống nghèo nhất, học vấn thấp và nơi mà cuộc sống hàng ngày là khai thác rừng và mức sống thấp, đốt nương làm rẫy [196],[71],[180].
Hơn nữa, trong các khu rừng và các khu vực rừng bị tàn phá, nhiều công nhân đến sinh sống trong những chòi thô sơ (nhà rẫy) và nơi ở khác trong thời gian thu hoạch thì khả năng bảo vệ chống lại muỗi đốt là rất thấp. Sự di chuyển dân số giữa các vùng khác nhau, cùng với các điều kiện sống nói chung là kém nên tiếp xúc với nguy cơ sốt rét cao. Các yếu tố xã hội như sống ở những khu vực vùng xâu vùng xa và những khó khăn về cách tiếp cận trong việc thực hiện và duy trì những nỗ lực kiểm soát chống lại các vector rừng hiệu quả cao cho truyền bệnh sốt rét [17],[196],[18],[197],[26].
Sau các trường hợp mắc bệnh sốt rét tại địa phương cuối cùng đã được báo cáo ở miền Bắc Việt Nam vào năm 1995, lan truyền sốt rét đã không quay trở lại mặc dù các báo cáo cho rằng các vector sốt rét vẫn phổ biến [7],[198],[199]. Một nghiên cứu về hệ thống thông tin y tế về hoạt động giám sát sốt rét ở Việt Nam [200] được gọi vào câu hỏi về tính chính xác của dữ liệu thu thập và cho rằng có khả năng một đánh giá quá thấp cho gánh nặng sốt rét thực tế được báo cáo trong suốt thập kỷ qua.
Bằng cách áp dụng các công cụ phân tích không gian-thời gian để xác định sự liên kết giữa các khía cạnh xã hội, các yếu tố môi trường và nguy cơ sốt rét ở Việt Nam, Bùi và cộng sự, (2011) bị nghi ngờ lan truyền sốt rét vẫn còn xảy ra ở một số khu vực trọng điểm của miền Bắc Việt Nam, do đó, nhấn mạnh các hoạt động giám sát sốt rét và khả năng phòng chống nên được duy trì để kiểm soát hoặc đáp ứng việc quay trở lại của bệnh sốt rét ở một số khu vực dễ xảy ra.
 !important; !important; |
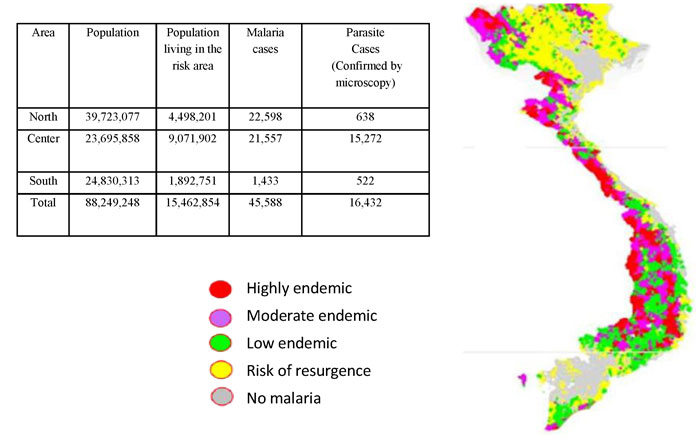
Tỷ lệ nhiễm sốt rét ở người và tỷ lệ muỗi nhiễm KSTSR đã được báo cáo ở một số tỉnh phía Nam và miền Trung Việt Nam như Bình Thuận, Ninh Thuận, Khánh Hòa, Quảng Bình, Bình Phước, Đắk Nông, Đắk Lắk, Bạc Liêu [7],[181],[42],[180],[43],[183],[195].
 !important; !important; |
| Hình 6. Tổng dân số sống ở khu vực có nguy cơ, số ca SR và số ca (+) ở Việt Nam trong năm 2011 |
Đa dạng sinh học muỗi Anopheles ở Việt Nam
Việt Nam, có 61 loài Anopheles đã được báo cáo bằng các phương pháp định loại bằng hình thái [201]. Nhiều loài Anopheles từ Đông Nam Á thuộc nhóm loài hoặc phức hợp loài [39]. Đối với các phức hợp loài, vì có thể không có hoặc các đặc điểm hình thái không nhận ra để phân biệt chính xác từng loài anh chị em với nhau. Do vậy, vai trò cụ thể của chúng trong lan truyền sốt rét không rõ ràng [202],[203],[40]. Anopheles ở Việt Nam có thể được phân chia thành 3 mức dựa vào khả năng vector của chúng đối với lan truyền sốt rét:
(i)Các vector chính bao gồm phức hợp loài Dirus (An. dirus), Minimus (An. minimus, An. harrisoni) và Sundaicus (An. epiroticus).
(ii)Vector phụ hoặc thứ yếu bao gồm An. aconitus, An. jeyporiensis, An. maculatus, An. subpictus, An. sinensis, An. pampanai, An. vagus, An. indefinitus.
(iii)Các vector nghi nghờ là An. interruptus, An. campestris, An. lesteri and An. nimpe.
!important; |
Do vậy, 16 loài (26%) được xem như có một số vai trò trong lan truyền sốt rét. Tuy nhiên, nghiên cứu thêm nữa là cần thiết để xác định rõ hơn tầm quan trọng và vai trò của mỗi loài, đặc biệt là các vector thứ yếu hoặc các vector nghi ngờ. Ví dụ, An. culicifacies s.l., vector quan trọng ở Ấn Độ, gần đây được tìm thấy ở Việt Nam. Tuy nhiên, loài được xác định là An.culicifacies loài B của Phức hợp Culicifacies đây là loài ưa thích đốt động vật và do vậy được xem như không liên quan đến lan truyền sốt rét ở Việt Nam [54]. Ngoài ra, thay đổi môi trường lớn đã xảy ra kể từ những năm 1990, điều này đã thay đổi môi trường sống muỗi Anopheles và sự có mặt và phổ biến của một số loài.
Phân bố vector Anopheles ở Việt Nam.
Theo Vũ Thị Phan (2008), quần thể Anopheline ở Việt Nam đã được phân loại dựa vào hai tiêu chuẩn [204]:
• Về mặt địa lý, được phân thành 4 khu vực: miền Bắc, Nam Trung bộ-Tây Nguyên, miền Nam và Lâm Đồng (tỉnh ở Nam-Trung Việt Nam trong vùng có khí hậu ôn đới).
• Địa lý tự nhiên, bằng cách kết hợp dịch tễ học dịch bệnh và hợp lại thành 7 vùng khác nhau: (1) Đồng bằng với nước đứng, (2) đồi thấp với các dòng suối, (3) núi đồi thấp và vùng rừng với các dòng suối, (4) núi và rừng với các dòng suối, (5)cao nguyên phía Bắc, 6) Vùng núi cao với những con suối và thác nước, và (7) môi trường sống nước lợ ven biển.
!important; |
Các vector như An. minimus và An. dirus có mặt ở hầu hết các vùng, trong khi An. epiroticus và An. subpictus là những vector giới hạn dọc theo bờ biển với mức độ nước lợ khác nhau trong các hồ chứa tự nhiên (ví dụ, đầm phà, suối ven biển bị chặn và các dòng sông nhỏ). Sự phân bố của các loài vector phổ biến gần đây đã được mô tả chi tiết [59]. Nhiều nghiên cứu đã góp phần vào những hiểu biết mới về sự hiện diện, sinh học và tập tính và phân bố Anopheles ở Việt Nam.
Đa số các cuộc điều tra đã tập trung vào khu vực miền Trung và miền Nam, nơi lan truyền sốt rét lưu hành nhiều nhất. Ở xã Ma Nới và xã Phước Bình, khu vực rừng của tỉnh Bình Thuận, thuộc miền Trung Việt Nam, có 24 loài Anopheles được thu thập từ năm 2004 đến 2006. Các vector phổ biến là An. dirus và An. minimus s.l. và cũng bao gồm An. maculatus s.l., An. pampanai, An. aconitus, An.annularis s.l., An. nigerrimus, An. philippinensis, An. sinensis, An. annandalei, An. argyropus, An.barbumbrosus, An. crawfordi, An. jamesii, An. jeyporiensis, An. monstrosus, An. tessellatus, An. vagus, An. varuna, An. barbirostris, An. kochi, An. nivipes, An. peditaeniatus, và An. splendidus [43].
Một nghiên cứu trên phạm vi toàn quốc để đánh giá tình hình và sự phân bố vector sốt rét Anopheles ở 4 khu vực rừng ở miền Bắc Việt Nam (phía Bắc Đèo Hải Vân) đã ghi nhận có 30 loài Anopheles, trong đó có 20 loài được thu thập ở rừng nguyên rừng, 21 loài thu thập ở rừng phát triển thứ sinh, 16 loài ở sinh thái rừng hoặc cây bụi và 6 loài được thu thập trong khu rừng ngập mặn. Hai vector sốt rét chính đã có mặt là An. minimus s.l. và An. dirus, cũng như các vector phụ bao gồm An. aconitus, An. jeyporiensis, An. maculatus, An. subpictus, An. sinensis và An. donaldi [205].
!important; |
Các loài anh chị em cùng khu vực phân bố, An. minimus và An. harrisoni đã được xác nhận tại tỉnh Hòa Bình ở phía đông bắc Việt Nam [32] cũng như 21 loài Anopheles khác gần đập thủy điện Sơn La (Sơn La tỉnh), bao gồm An. minimus [199]. Phát hiện này cho thấy, mặc dù ngay cả tỷ lệ mắc sốt rét ở khu vực này rất thấp nhưng nguy cơ mắc sốt rét vẫn còn và khả năng kiểm soát vector ở khu vực này nên được duy trì để phòng chống hoặc chống lại bệnh sốt rét có thể bùng phát.
Các phương pháp phân tử đã được phát triển để giải quyết các vấn đề kho khăn trong địnhloại là do sự chồng chéo ở các đặc điểm hình thái giữa các loài anh chị em [206], [207],[208],[55],[209],[210],[211]. Sự phân bố loài có đặc điểm hình thái ngoài giống hệt nhau đã được làm sáng tỏ ở nhiều các địa phương.
Ở Việt Nam, loài An. minimus phân bố rộng từ bắc vào nam, trong khi An. harrisoni chỉ phân bố một số vùng [212]. Sự có mặt của An. minimus và An. harrisoni xảy ra từ phía Bắc đến khu vực Nam Trung Bộ, nơi chúng thường xuyên xảy ra trong cùng khu vực phân bố [213],[32],[212],[242]. Ở miền Trung Việt Nam, sự gia tăng mật độ An. harrisoni đã được nhìn thấy so với An.minimus mà cũng trùng hợp với việc sử dụng rộng rãi màn ngủ tẩm permethrin trong làng nghiên cứu [7],[213]. Sự phổ biến An. harrisoni cũng đã được báo cáo tại tỉnh Quảng Bình, bắc miền Trung Việt Nam [42].
Trong số 8 loài của Phức hợp loài Dirus thì chỉ có hai loài xảy ra tại Việt Nam là Anopheles dirus, vector sốt rét chính được tìm thấy ở các vùng đồi núi rừng [32],[41],[18],[42],[43] và gần đây được mô tả loài bí ẩn, An. aff. takasagoensis được thu thập ở miền bắc Việt Nam [40]. Xã Khánh Phú (tỉnh Khánh Hòa ở nam trung bộ Việt Nam) là một khu vực đồi núi có rừng, nơi lan truyền sốt rét lưu hành. Tổng số 12 loài Anopheles được thu thập ơ khu vực này, trong đó An.dirus là loài chiếm ưu thế hiện nay (83,2%) [183]. Anopheles epiroticus được xem là vector sốt rét chính ở các khu vực ven biển phía nam dưới vĩ tuyến 11. Các nghiên cứu gần đây đã cho thấy tỷ lệ nhiễm rất thấp ở loài này [46],[58],[7],[214]. An. epiroticus là thành viên duy nhất của Phức hợp loài Sundaicus có mặt ở Việt Nam [58],[117],[32],[44].
!important; |
Gần đây, Anopheles nimpe (Nhóm Hycarnus) được miều tả và phát hiện dọc khu vực ven biển phía nam và nghi nghờ là vector sốt rét do nó có ái tính với người rất cao [45],[215],[32],[42]. Cho đến nay, có rất ít hiểu biết về loài này. Nhóm loài Maculatus có ba đại diện có mặt ở Việt Nam gồm An. maculatus, An. sawadwongporni và An. rampae (dạng K), với sự thay đổi về phân bố và mật độ dựa trên khu vực địa lý [42],[43]. Chỉ An. maculatus được coi như là một vector phụ quan trọng [45],[204]
Môi trường sống và tập tính vector
Anopheles dirus chính là vector sốt rét rừng và đây cũng là vector chính ở nhiều khu vực. Tuy nhiên, ở xã Trường Xuân (tỉnh Quảng Bình) and xã Phước Chiến (tỉnh Ninh Thuận), những địa điểm nơi mà lan truyền sốt rét vẫn cao, An. dirus đã được báo cáo không nhiễm [18,42], do vậy vai trò của các vector phụ trong lan truyền sốt rét có thể ước tính thấp [32,42,43].
Các loài của phức hợp Minimus thường được tìm thấy ở chân đồi rừng kết hợp với các dòng suối nước ngọt và các kênh rạch. Anopheles minimus cũng đã được tìm thấy ở những môi trường nhiều ánh sáng và ít ánh sáng An. minimus được tìm thất đẻ ở những dụng cụ chứa nước nhân tạo như các bồn chứa nước mưa gần nhà [204, 206, 216]. Anopheles epiroticus là vector sốt rét quan trọng dọc bờ biển miền Nam Việt Nam và cũng tìm thấy phổ biến trong các hồ tôm và cá do con người tạo ra. Loài này cũng đốt người suốt đêm [32].
Nhóm loài An. maculatus đã được tìm thấy ở các vùng rừng đồi núi, đặc biệt ở những khu vực rừng có diện tích thu hẹp. Môi trường sống ấu trùng có liên quan chặt chẽ với các hồ suối và đáy sông đang khô. Chúng thường đốt động vật, thích đốt gia súc hơn là con người và có xu hướng đốt vào đầu hôm cho đến rạng sáng [32, 42, 43].
!important;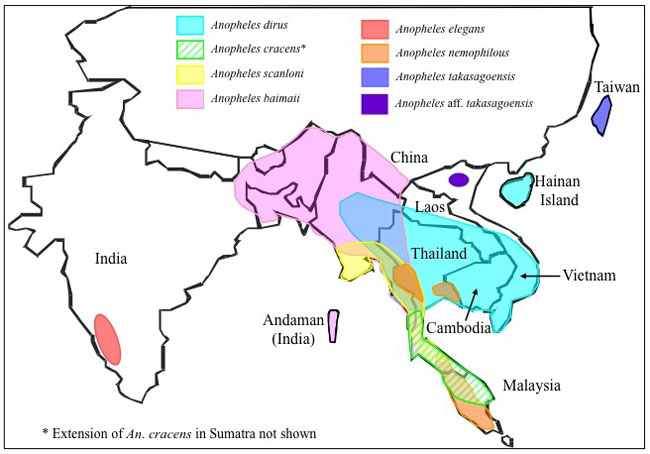 |
Tác động của thay đổi các điều kiện xã hội và môi trường đến vector và lan truyền
Thay đổi môi trường rộng lớn đã xảy ra ở Việt Nam kể từ những năm 1990 [217], điều này đã làm biến đổi môi trường sống Anopheles và sự hiện diện và phổ biến của một số loài. Anopheles minimus, được biết đến như là một vector ưa đốt trong nhà và thường thích đốt người, loài này phong phú chủ yếu vào mùa khô thường kéo dài từ tháng 11 đến tháng 4 ở miền Nam và từ tháng 11 đến tháng 2 ở miền bắc Việt Nam [7].
Việc sử dụng hóa chất diệt côn trùng phun tồn lưu trong nhà đã được sử dụng thành công để giảm lan truyền sốt rét vì An. minimus có xu hướng bay vào nhà đốt người. Tuy nhiên, sự thích nghi này đã cho thấy sự thay đổi trong hành vi được đánh dấu từ ưa đốt trong nhà sang ưa đốt ngoài nhà và từ ưa thích đốt người sang ưa thích đốt động vật ở miền Bắc Việt Nam, nơi nó thu hút gia súc hơn và các vật nuôi khác gần nhà [32],[34],[42]. Song song đó, việc sử dụng hóa chất diệt côn trùng dẫn đến sự gia tăng đáng kể mật độAn. harrisoni ở xã Phú Khánh [213].
Thói quen của con người đang tạo ra sự thay đổi môi trường quan trọng trên phạm vi cả nước, như phá rừng, tái trồng rừng, trồng các điền, các hồ tôm và hồ nuôi cá thay thế ruộng, xây dựng đường, đập và các hoạt động phát nương làm rẫy diễn ra mạnh mẽ
 !important; !important; |
Như vậy, thay đổi sử dụng đất có ảnh hưởng đến môi trường sống, đa dạng và phân bố vector điều này có thể thúc đẩy hoặc ngăn cản sự sinh sản của một số loài vector và do đó ảnh hưởng đến nguy cơ lan truyền bệnh sốt rét [199], [218]. Trong môi trường đô thị và nông thôn, sự mở rộng lưới điện cho các xã miền núi và các ngôi làng vùng xa khuyến khích mọi người vẫn còn ngoài trời trong thời gian dài hơn vào thời gian ban đêm, do đó làm tăng nguy cơ ở cộng đồng không được bảo vệ này bị đốt bởi các vector sốt rét, đặc biệt là An. dirus loài có nhiều khả năng hoạt động và đốt ngoài nhà [32],[43]. Xây dựng nhà ở có tác động đến sự lan truyền bệnh sốt rét.
Nhà xây dựng tạm bợ (ví dụ, những bức tường dở dang, không có cửa) cho phép muỗi đốt người dễ dàng phát hiện các chất kích thích thu hút vật chủ người và vào nhà đốt người [32]. Gia tăng mức sống và phát triển kinh tế trong nước, vì vậy sẽ loại bỏ những ngôi nhà không đạt yêu cầu và xây dựng những ngôi nhà với các bức tường kiên cố để không cho vector vào đốt người [32],[43].
Tài liệu tham khảo
[2] World Health Organization. (2011). World malaria report. Nonserial Publication. World Health Organization. pp.270. ISBN 9789241564403.http://www.int/malaria/ world_malaria_report_2011/9789241564403_eng.pdf.
[3] World Health Organization. (2012). World malaria report. Non serial Publication. World Health Organization. pp.260. ISBN ISBN 978 92 4 156453 3. http:// www.who.int/malaria/publications/world_malaria_report_2012/en/index.html
[6] Verle, P.; Ruyen, N. T., N Huong,. T. N., Be, T., Kongs, A., Van der Stuyft, P., & Coosemans, M. (1998). A simple field test for detecting pyrethroids o !important;n impregnated nets. Tropical Medicine and International Health,Vol.3, pp. 833-6.
[7] Trung, H. D. !important; Van Bortel, W., Sochantha, T., Keokenchanh, K., Quang, N. T., Cong, L. D., & Coosemans, M. (2004). Malaria transmission and major malaria vectors in different geographical areas of Southeast Asia. Tropical Medicine and International Health, Vol. 9, pp. 230-7.
[17] Erhart, A. !important; Thang, N.D., Hung, N.Q., Toi, L.E.V., Hung, L.E.X., Tuy, T.Q., Cong, L.E.D., Speybroeck, N., Coosemans, M. & Alessandro, U.D. (2004). Forest malaria in Vietnam: A challenge for control. American Journal Tropical Medicine and Hygiene, Vol. 70, No.2,pp. 110-118. ISSN: 0002-9637.
[18] Sanh, N. H., Van Dung, N., Thanh, N. X., Trung, T. N., Van Co, T., Cooper, R. D. (2008). Forest malaria in central Vietnam. American Journal of Tropical Medicine and Hygiene, Vol. 79, pp. 652-654.
[26] Bui, H. M., Clements,A. C., Nguyen, Q. T., Nguyen, M. H., Le, X. H., Hay, S. I.,
Tran,T. H., Wertheim, H. F., Snow, R. W., Horby, P. (2011). Social and environmental
determinants of malaria in space and time in Viet Nam. Int J Parasitol, Vol. 41, pp. 109-16.
[32] Trung, H. D. !important; Bortel, W. V., Sochantha, T., Keokenchanh, K., Briet, O. J., & Coosemans, M. (2005). Behavioural heterogeneity of Anopheles species in ecologically different localities in Southeast Asia: a challenge for vector control. Tropical Medicine and
International Health, Vol. 10, pp. 251-262.
[39] Harbach, R. E. (2011). Anopheles classification. Mosquito Taxonomic Inventory
(http://.mosquito-taxonomic-inventory.info/). accessed o !important;n 20 January 2013.
[40] Takano, K. T.; Nguyen, N. T., Nguyen, B. T., Sunahara, T., Yasunami, M., Nguyen, M. D., & Takagi, M. (2010). Partial mitochondrial DNA sequences suggest the existence of a cryptic species within the Leucosphyrus Group of the genus Anopheles (Diptera: Culicidae), forest malaria vectors, in northern Vietnam. Parasite & !important; Vectors Vol. 3, pp. 41.
[41] Obsomer, V. !important; Defourny, P., & Coosemans, M. (2007). The Anopheles dirus complex: spatial distribution and environmental drivers. Malaria Journal, Vol. 6, pp. 26.
[42] Manh, C. D. !important; Beebe, N. W., Van, V. N., Quang, T. L., Lein, C. T., Nguyen,D. V., Xuan,
T. N., Ngoc, A. L., & !important; Cooper, R. D. (2010). Vectors and malaria transmission in deforested, rural communities in north-central Vietnam. Malaria Journal, Vol. 9, pp. 259.
[43] Van Bortel, W. !important; Trung,H. D., Hoi le, X., Van Ham, N., Van Chut, N., Luu, N. D., Roelants, P., Denis, L., Speybroeck, N., D'Alessandro, U., & Coosemans, M. (2010). Malaria transmission and vector behaviour in a forested malaria focus in central
Vietnam and the implications for vector control. Malaria Journal, Vol. 9: 373.
[45] Nguyen, T. A. (1993). [Malaria in Vietnam.Environment, prevention and treatment]. Bull Soc Pathol Exot 86: 494-9.
[46] Dusfour, I. !important; Harbach, R.E. & Manguin, S. (2004). Bionomics and systematics of the oriental Anopheles sundaicus complex in relation to malaria transmission and vector control. Am J Trop Med Hyg. Vol. 71, pp. 518-524. ISSN: 0002-9637.
[54] Van Bortel, W. !important; Sochanta, T., Harbach, R. E., Socheat, D., Roelants, P., Backeljau, T., &
Coosemans, M. (2002). Presence of Anopheles culicifacies B in Cambodia established by the PCR-RFLP assay developed for the identification of Anopheles minimus species A and C and four related species. Medical Veterinary Entomology, Vol. 16, pp. 329-34.
[55] Garros, C. !important; Harbach, R. E., &Manguin, S. (2005). Systematics and biogeographical implications of the phylogenetic relationships between members of the Funestus and Minimus groups of Anopheles (Diptera: Culicidae). Journal of Medical Entomology, Vol. 42, pp. 7-18.
[56] Van Bortel, W. !important; Trung, H. D., Thuan le, K., Sochantha, T., Socheat, D., Sumrandee, C., Baimai, V., Keokenchanh, K., Samlane, P., Roelants, P., Denis, L., Verhaeghen, K., Obsomer, V., & Coosemans, M. (2008). The insecticide resistance status of malaria vectors in the Mekong region. Malaria Journal, Vol. 7: 102.
[58] Dusfour, I., Linton, Y. M., Cohuet, A., Harbach, R. E., Baimai, V., Trung, H. D., Seng, C. M., Matusop, A., Manguin, S. (2004). Molecular evidence of speciation between island and continental populations of Anopheles (Cellia) sundaicus (Diptera: Culicidae), a principal malaria vector taxon in Southeast Asia. Journal of Medical Entomology, Vol. 41, pp. 287-95.
[59] Sinka, M. E. !important; Bangs, M. J., Manguin, S., Chareonviriyaphap, T., Patil, A. P., Temperley, W. H., Gething, P. W., Elyazar, I. R., Kabaria, C. W., Harbach, R. E. & Hay, S. I. (2011). The dominant Anopheles vectors of human malaria in the Asia-Pacific region: occurrence data, distribution maps and bionomic précis. Parasite & !important; Vectors, Vol. 4, pp. 89.
[75] Yasuoka, J. !important; & Levins, R. (2007). Impact of deforestation and agricultural development on anopheline ecology and malaria epidemiology. American Journal of Tropical Medicine and Hygiene. Vol. 70, No. 3, pp. 450-460. ISSN 0002-9637.
[117] Linton, Y.M. !important; Dusfour, I, Howard, T.M., Ruiz, L., Nguyen, D.M., Trung, H.D., Sochantha, T., Coosemans, M., & Harbach, R.E. (2005). Anopheles (Cellia) epiroticus (Diptera: Culicidae), a new malaria vector species in the Southeast Asian Sundaicus Complex. Bulletin of Entomological Research. Vol 95, pp. 329-339
[179] Marchand, R. !important; Tuyen, N. Q., Hoanh, N. Q., & Vien, N. T. (1996). The Khanh Phu malaria research project, pp. 168, Review Meetings 1-2 March 1996. Medical Publishing House 1997, Hanoi.
[180] Grietens, P. K. !important; Xuan, X. N., Van Bortel, W., Duc, T. N., Ribera, J., Ba Nhat, M. T., Van, K. P., Le Xuan, H., D'Alessandro, U., & Erhart, A. (2010). Low perception of malaria risk among the Ra-glai ethnic minority in south-central Vietnam: implications for forest malaria control. Malaria Journal, Vol. 9, pp. 23.
[181] Nakazawa, S. !important; Marchand, R. P., Quang, N. T., Culleton, R. N., Manh, D., & Maeno, Y. (2009). Anopheles dirus co-infection with human and monkey malaria parasites in Vietnam. International Journal Parasitology, Vol. 39, pp.1533-1537.
[182] Thang, N. D. !important; Erhart, A., Hung le, X., Thuan le, K., Xa, N. X., Thanh, N. N., Ky, P. V., Coosemans, M., Speybroeck, N., & D'Alessandro, U. (2009). Rapid decrease of malaria morbidity following the introduction of community-based monitoring in a rural area of central Vietnam. Malaria Journal, Vol. 8, pp. 3.
[183] Marchand, R. P. !important; Culleton, R., Maeno, Y., Quang, N. T., & Nakazawa, S. (2011). Coinfections of Plasmodium knowlesi, P. falciparum, and P. vivax among humans and Anopheles dirus mosquitoes, Southern Vietnam. Emerg Infect Dis, Vol.17, pp. 1232-9.
[184] Singh, B. !important; Kim Sung, L., Matusop, A., Radhakrishnan, A., Shamsul, S. S., Cox- Singh,J., Thomas, A., & Conway, D. J. (2004). A large focus of naturally acquired Plasmodium knowlesi infections in human beings. Lancet, Vol. 363, pp. 1017-24.
[185] Cox-Singh, J. !important; & Singh., B. (2008a). Knowlesi malaria: newly emergent and of public health importance? Trends Parasitol, Vol. 24, pp. 406-10.
[186] Cox-Singh, J. !important; Davis, T.M., Lee, K.S., Shamsul, S.S., Matusop, A., Ratnam, S., Rahman, H.A., Conway, D.J., & Singh, B. (2008b). Plasmodium knowlesi malaria in humans is widely distributed and potentially life threatening. Clinical Infectious Diseases, Vol. 46, No.2, pp. 165-171.
[187] Cox-Singh, J. !important; Hiu, J., Lucas,S. B., Divis,P. C., Zulkarnaen, M., Chandran, P., Wong, K. T., Adem,P., Zaki, S. R., Singh,B., Krishna, S. (2010). Severe malaria - a case of fatal Plasmodium knowlesi infection with post-mortem findings: a case report. Malaria Journal, Vol. 9, pp. 10.
[188] Cox-Singh, J. (2009). Knowlesi malaria in Vietnam. Malaria Journal, Vol. 8, pp. 269.
[189] Van den Eede, P. !important; Van, H. N., Van Overmeir, C., Vythilingam, I., Duc, T. N., Hung le, X., Manh, H. N., Anne, J., D'Alessandro, U., & Erhart, A. (2009). Human Plasmodium knowlesi infections in young children in central Vietnam. Malaria Journal, Vol. 8: 249.
[190] Hung le, Q. !important; Vries, P. J., Giao, P. T., Nam, N. V., Binh, T. Q., Chong, M. T., Quoc, N. T., Thanh, T. N., Hung, L. N., & Kager, P. A. (2002). Control of malaria: a successful experience from Viet Nam. Bull World Health Organ 80: 660-6.
[191] Huong, N. M. !important; Hewitt, S., Davis, T. M., Dao, L. D., Toan, T. Q., Kim,,T. B., Hanh, N. T., Phuong, V. N., Nhan, D. H., & Cong, L. D. (2001). Resistance of Plasmodium falciparum to antimalarial drugs in a highly endemic area of southern Viet Nam: a study in vivo and in vitro. Trans R Soc Trop Med Hyg, Vol. 95, pp. 325-9.
[192] Ngo, T. !important; Duraisingh, M., Reed, M., Hipgrave, D., Biggs, B., & Cowman, A. F. (2003). Analysis of pfcrt, pfmdr1, dhfr, and dhps mutations and drug sensitivities in Plasmodium falciparum isolates from patients in Vietnam before and after treatment with artemisinin. American Journal of Tropical Medicine and Hygiene, Vol. 68, pp. 350-356.
[193] Van Bortel, W. !important; Chinh, V. D., Berkvens, D., Speybroeck, N., Trung, H. D., & Coosemans, M. (2009). Impact of insecticide-treated nets on wild pyrethroid resistant Anopheles epiroticus population from southern Vietnam tested in experimental huts. Malaria Journal, Vol. 8: 248.
[194] Verhaeghen, K.; Van Bortel, W., Trung, H. D., Sochantha, T., & Coosemans, M. (2009). Absence of knockdown resistance suggests metabolic resistance in the main malaria vectors of the Mekong region. Malaria Journal, Vol. 8: 84.
[195] IMPEQN. (2012). Statistic data of malaria case in Central Highlands Vietnam. Institute of malaria, parasite and Entomology sub Quy Nhon.
[196] Erhart, A. !important; Ngo, D. T., Phan, V. K., Ta, T. T., Van Overmeir, C., Speybroeck, N., Obsomer, V., Le, X. H., Le, K. T., Coosemans, M., D'Alessandro, U. (2005). Epidemiology of forest malaria in central Vietnam: a large scale cross-sectional survey. Malaria Journal, Vol. 4, pp. 58.
[197] Abe, T. !important; Honda, S., Nakazawa, S., Tuong, T. D., Thieu, N. Q., Hung le, X., Thuan le, K., Moji, K., Takagi, M., & Yamamoto, T. (2009). Risk factors for malaria infection among ethnic minorities in Binh Phuoc, Vietnam. Southeast Asian J Trop Med Public Health, Vol. 40, pp. 18-29.
[198] Nguyen, V. Q. (2005). Chemical methods applicable for the areas with low malarial prevalence in Bac Kan province, pp. 30. NIMPE - Hanoi.
[199] Tran, Q. T. (2005). Epidemiological studies of malaria and the malarial prevention measures, applicable at Son La hydro-electrical areas pp. 50. NIMPE - Hanoi.
[200] Erhart, A !important; Thang, N. D., Xa, N. X., Thieu, N. Q., Hung, L. X., Hung, N. Q., Nam, N. V., Toi, L. V., Tung, N. M., Bien, T. H., Tuy, T. Q., Cong, L. D., Thuan, L. K., Coosemans, M., and D'Alessandro, U. (2007). Accuracy of the health information system on malaria surveillance in Vietnam. Transaction Royal Society of Tropical Medicine and Hygiene, Vol. 101, pp. 216-25.
[201] NIMPE. (2008). Keys to identify of Anopheles mosquitoes (Adults-Pupae-Larvae). Department of Entomology, Institute of Malariology, Parasitology and Entomology, Hanoi.
[202] Van Bortel, W. !important; Harbach, R. E., Trung, H. D., Roelants, P., Backeljau, T., & Coosemans, M. (2001). Confirmation of Anopheles varuna in Vietnam, previously misidentified and mistargeted as the malaria vector Anopheles minimus. American Journal of Tropical Medicine and Hygiene, Vol. 65, pp. 729-32.
[203] Cuong do, M. !important; Van, N. T., Tao le, Q., Chau,T. L., Anh le, N., Thanh, N. X., & Cooper, R. D. (2008). Identification of Anopheles minimus complex and related species in Vietnam. Southeast Asian JTrop Med Public Health 39: 827-31.
[204] Phan, V. T. [ed.] (1998). Epidemiologie du paludisme et lutte antipaludique au Vietnam. Editions Médicales Vietnam, Hanoi.
[205] Vu, D. C. (2006). Distribution of Anopheles mosquito and the malarial transmission vector in some forested habitat, located in northern part of Vietnam, pp. 40. NIMPE - Hanoi, Hanoi.
[206] Van Bortel, W.; Trung, H. D., Manh, N. D., Roelants, P., Verle, P., & Coosemans, M. (1999). Identification of two species within the Anopheles minimus complex in northern Vietnam and their behavioural divergences. Tropical Medicine and International Health, Vol. 4, pp. 257-65.
[207] Walton, C. !important; Handley, J. M., Kuvangkadilok, C., Collins, F. H., Harbach, R. E., Baimai, V., & Butlin, R. K. (1999). Identification of five species of the Anopheles dirus complex from Thailand, using allele-specific polymerase chain reaction. Medical Veterinary Entomology, Vol. 13, pp. 24-32.
[208] Garros, C. !important; Koekemoer, L. L., Kamau, L., Awolola, T. S., Van Bortel, W., Coetzee, M., Coosemans, M., & Manguin, S. (2004). Restriction fragment length polymorphism method for the identification of major African and Asian malaria vectors within the Anopheles funestus and An. minimus groups. American Journal of Tropical Medicine and Hygiene, Vol. 70, pp. 260-265.
[209] Ma, Y. !important; Li, S., & Xu, J. (2006). Molecular identification and phylogeny of the Maculatus Group of Anopheles mosquitoes (Diptera: Culicidae) based o !important;n nuclear and mitochondrial DNA sequences. Acta Tropica, Vol. 99, pp. 272-80.
[210] Walton, C. !important; Somboon, P., Harbach, R. E., Zhang, S., Weerasinghe, I., O'Loughlin, S. M., Phompida, S., Sochantha, T., Tun-Lin, W., Chen, B., & Butlin, R. K. (2007a). Molecular identification of mosquito species in the Anopheles annularis group in southern Asia. Medical Vet Entomology, Vol. 21, pp. 30-35.
[211] Walton, C. !important; Somboon, P., O'Loughlin, S. M., Zhang, S., Harbach, R. E., Linton, Y. M., Chen, B., Nolan, K., Duong, S., Fong, M. Y., Vythilingam, I., Mohammed, Z. D., Trung, H. D., Butlin, R. K. (2007b). Genetic diversity and molecular identification of mosquito species in the Anopheles maculatus group using the ITS2 region of rDNA. Infectious Genetic Evoluation, Vol. 7: 93-102.
[212] Garros C., Nguyen C.V., Trung H.D., Van Bortel W., Coosemans M., ManguinS.. (2008). Distribution of Anopheles in Vietnam, with particular attention to malaria vectors of the Anopheles minimus complex. Malaria Journal, Vol 7, pp 11.
[213] Garros, C.; Marchand, R. P., Quang, N. T., Hai, N. S., & Manguin, S. (2005b). First record of Anopheles minimus C and significant decrease of An. minimus A in central Vietnam. Journal of American Mosquito Control Association, Vol. 21, pp. 139-43.
[214] Le, X. H. (2006). Investigating into composition and distribution of Anopheles mosquitoes, malarial vectors in the U Minh forest and evaluation of Agnique MMF effectiveness, sed in controlling of An. sundaicus larvae, pp. 28. NIMPE -Hanoi.
[216] Van Bortel, W. !important; Trung, H. D., Roelants, P., Backeljau,T., & Coosemans, M. (2003). Population genetic structure of the malaria vector Anopheles minimus A in Vietnam. Heredity (Edinb), Vol. 91, pp.487-93.
[218] Ho, V. H. (2008). Baseline survey o !important;n malaria and appropriated measures in malarial prevention for migrant population in Dak Glong District - Dak Nong Province. pp. 57. IMPE-Quy Nhon.