“Tử dược” Mediator làm chao đảo y tế Pháp
Sóng gió từ vụ “tử dược” Mediator đang dồn dập giáng vào Tập đoàn Servier và khuấy động cả hệ thống y tế Pháp. Theo tờ Le Parisien đăng tải, các nhà điều tra thuộc Cơ quan Trung ương phòng, chống xâm hại môi trường và sức khỏe cộng đồng (Oclaesp) vừa thẩm vấn nhiều nhân viên cao cấp của hãng Servier, nơi sản xuất thuốc Mediator. Trong giai đoạn được lưu hành ở Pháp từ 1976-2009, loại thuốc dành cho bệnh nhân tiểu đường thừa cân này bị cáo buộc đã làm thiệt mạng từ 500 -2.000 người do tác dụng phụ nguy hại đến hệ tim mạch.
Tập đoàn lắm chiêu
Kết quả điều tra của Oclaesp sẽ được bổ sung vào các báo cáo của Cơ quan An ninh sản phẩm y tế Pháp (Afssaps) và Ban Tổng thanh tra các vấn đề xã hội (Igas). Theo các thanh tra của Igas, trước khi tung Mediator ra thị trường, Servier biết rõ hoạt chất benfluorex trong thuốc là một chất gây chán ăn rất mạnh và tìm mọi cách lấp liếm chuyện này. Báo cáo của Igas ghi nhận: “Khi benfluorex (Mediator) được lưu hành năm 1976, Servier đã giới thiệu nó như một loại thuốc bổ trợ cho bệnh nhân tiểu đường type 2 qua việc tác động lên cơ chế chuyển hóa của đường và mỡ, chứ không phải thuốc gây chán ăn”. Ngoài ra, theo Tổ chức Y tế thế giới, tiếp tố “orex” được dùng chỉ các hoạt chất gây chán ăn. Vì thế, năm 1973, Servier thậm chí còn đề nghị đổi tên benfluorex thành “benzaflumine” hay “benflurate”.
Báo cáo của Igas cho thấy, trong 33 năm xuất hiện trên thị trường dược phẩm Pháp, Mediator đã thoát hiểm 3 lần nhờ “sự khoan dung khó hiểu” của các cơ quan kiểm định y tế. Năm 1995, Pháp cấm nhiều thuốc chứa các dược chất gây chán ăn, trong đó có hoạt chất fenfluramine, “bà con gần” của benfluorex (cả hai đều là dẫn xuất của norfenfluramine) nhưng Mediator vẫn bình an vô sự. Tiếp đó, năm 1997 và 1999, một số thuốc tương tự Mediator như Isoméridelại tiếp tục bị cấm nhưng “tử dược” của hãng Servier vẫn có mặt trên thị trường thêm hàng chục năm nữa.
Cải tổ toàn diện
Bộ trưởng Lao động và Y tế Xavier Bertrand mới đây nhìn nhận với báo giới: “Hệ thống thuốc men của chúng ta còn nhiều khiếm khuyết nghiêm trọng và các cơ quan kiểm định dược phẩm đã không hoàn thành nhiệm vụ”. Hôm 17.1, trên Đài truyền thanh France Inter, ông Bertrand cho biết dự kiến luật cải cách hệ thống kiểm định dược phẩm sẽ được đưa ra trước năm 2012.
Theo Le Monde, một trong những biện pháp cải tổ được Bộ trưởng Bertrand nhấn mạnh là giữ cho Afssaps hoạt động hoàn toàn độc lập với các hãng dược. Như vậy, kinh phí hoạt động của cơ quan này phải do Chính phủ Pháp chu cấp hoàn toàn. Hiện nay, 80% ngân sách của Afssaps là từ các hãng dược. Ông Bertrand cũng cho rằng cần bổ sung thêm đại diện của các hiệp hội người tiêu dùng, chuyên san y khoa độc lập vào các ủy ban kiểm định chất lượng dược phẩm của Afssaps.
Về lâu dài, việc cấp phép lưu hành cho các loại thuốc tại Pháp có thể sẽ thay đổi. Hiện nay, để được lưu hành, các hãng dược chỉ cần chứng minh loại thuốc mới có hiệu quả cao hơn giả dược. Nhưng trong tương lai, tờ Le Figaro dẫn lời Bộ trưởng Bertrand cho biết: “Các loại thuốc mới phải chứng tỏ dược tính bằng hoặc hơn thuốc đã có trên thị trường”. Vụ bê bối Mediator đã thật sự thay đổi cơ chế quản lý dược phẩm tại Pháp. Ngoài phản ứng từ Bộ Lao động, Y tế, các cơ quan hữu trách khác đều kêu gọi cải cách. Nhiều hiệp hội dược phẩm đã “nghỉ chơi” với Tập đoàn Servier. Afssaps thời gian gần đây cũng tỏ ra rất tích cực khi vừa công bố danh sách 59 loại thuốc “cần theo dõi” đặc biệt vì lo ngại tác dụng phụ.
Vụ “Tử dược” Mediator: Chậm hay lơ?
Sau khi bài báo "Tử dược"" Meddiator vẫn được bày bán!"ra, nhiều ý kiến cho rằng, cơ quan quản lý dược phẩm trong nước quá chậm trễ trong việc cập nhật thông tin về những tác dụng phụ gây chết người của thuốc; cũng như rất dễ dãi sau khi nước sản xuất Mediator là Pháp, và các nước châu Âu, Mỹ đã cảnh báo rất nhiều về tác hại của Mediator và cho ngưng sử dụng loại thuốc này.
Cộng với hãng sản xuất thuốc (Công ty Les Laboratoires Servier, Pháp) chủ động có đơn xin rút số đăng ký đối với Mediator, nhưng Cục Quản lý dược Việt Nam vẫn tiếp tục cho bán nốt số thuốc mà một công ty (không phải hãng sản xuất) đã nhập và phân phối Mediator vào Việt Nam!
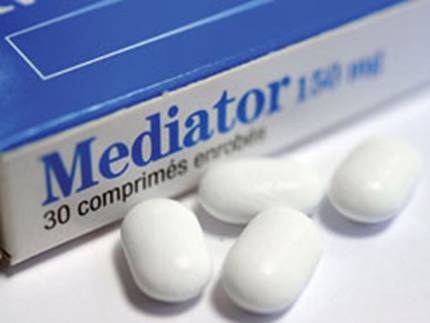 |
Biệt dược Mediator đã bị nhiều nước cấm - Ảnh: AFP |
Nhiều người lấy làm lạ, đặt câu hỏi: “Tại sao thông tin về tác hại lên hệ tim mạch của Mediator được rất nhiều quốc gia cảnh báo như thế mà ngành y tế VN lại không hề hay biết; hay là biết nhưng làm lơ để thuốc được tiêu thụ cho hết?”. Thắc mắc như vậy là có cơ sở vì các nước đã cấm sử dụng biệt dược Mediator (có hoạt chất benfluorex) từ cuối năm 2009, nhưng 8 tháng sau, Cục Quản lý dược Việt Nam cũng không có quyết định gì; bác sĩ nào đọc được thông tin từ các nước (số này không nhiều) thì ngưng không cho bệnh nhân của mình dùng Mediator nữa, còn bác sĩ nào không biết thì cứ thế kê toa.
Và rồi, khi Les Laboratoires Servier có đơn đệ trình lên Cục, thì ngày 30.8.2010, Cục mới ra quyết định cho rút số đăng ký Mediator tại Việt Nam. Xin nhắc lại, Cục cho rút số đăng ký thôi chứ không phải cấm lưu hành Mediator - vì ở điều 2 trong quyết định nói trên, Cục có thòng một câu, các thuốc Mediator sản xuất trước ngày 30.8 vẫn được lưu hành đến hết hạn dùng của thuốc. Thòng câu đó, thực chất Cục ngụ ý rằng, tất cả số thuốc đã nhập vào Việt Nam trước ngày 30.8 vẫn được tiêu thụ cho đến khi thuốc hết hạn sử dụng! Nghĩa là cho phép công ty nhập thuốc bán hết số thuốc đã nhập. Động thái đó đã khiến nhiều người phải suy nghĩ rằng, cơ quan quản lý y tế đã xem nhẹ sức khỏe người bệnh.
Thị trường mua bán, sử dụng thuốc chữa bệnh ở Việt Nam được ví dễ như mua bán bó rau, viên kẹo. Bác sĩ làm dược sĩ; dược sĩ thì làm bác sĩ... Do vậy, nếu việc cơ quan quản lý dược phẩm chậm chạp trong việc công bố những khuyến cáo về tác hại của thuốc sẽ khiến người bệnh phải lãnh đủ những tác hại, bởi họ tự mua, tự sử dụng thuốc.
59 loại thuốc “cần theo dõi” của AFSSAPS
Cơ quan an ninh về quản lý các sản phẩm y tế của Pháp (AFSSAPS_ Agence Francaise de Securite Sanitaire des Produits de Sante) đã đưa danh mục thuốc hoặc vaccine vào diện theo dõi:
1.Abstral (giảm đau);
2.Aclasta 5mg (chống loãng xương);
3.Acomplia (chống béo phì);
4.Alli 60mg (trị thừa cân);
5.Antasol (giảm đau);
6.Arcoxia (kháng viêm không steroid dành cho bệnh nhân thoái hóa khớp);
7.Byetta (trị tiểu đường);
8.Celsentri (thuốc kháng HIV);
9.Cervarix (vaccine ngừa ung thư cổ tử cung);
10.Champix (cai thuốc lá);
11.Chlorhydrate de buprenorphine (cai nghiện ma túy);
12.Cimzia (trị đa viêm khớp, thấp khớp);
13.Cymbalta (chống trầm cảm);
14.Effentora (giảm đau);
15.Efient 10mg (ngừa tim mạch);
16.Ellaone (ngừa thai);
17.Entonox (thuốc giảm đau chuyên dụng);
18.Exjade (dành cho bệnh nhân có lượng chất sắt trong máu quá cao);
19.Firmagon (trị ung thư tuyến tiền liệt);
20.Galvus (trị tiểu đường);
21.Gardasil (vaccine ngừa papillomavirus);
22.Ilaris (kháng thể chống một số dạng viêm nhiễm);
23.Increlex (dành cho trẻ em lớn chậm);
24.Instanyl (giảm đau);
25.Intelence (thuốc kháng rétrovirus);
26.Intrinsa (thuốc dành cho phụ nữ không còn “hưng phấn” sau cắt bỏ buồng trứng, tử cung);
27.Isentress (dành cho bệnh nhân nhiễm HIV);
28.Januvia (trị tiểu đường type 2);
29.Kalinox (thuốc giảm đau chuyên dụng);
30.Kuvan (trị một số bệnh hiếm về chuyển hóa);
31.Lucentis (trị thoái hóa điểm vàng);
32.Methadone AP-HP (thuốc cai nghiện ma túy);
33.Multaq (trị bệnh tim);
34.Mycamine (trị bệnh nấm);
35.Nplate (làm tăng tiểu cầu);
36.Onglyza (trị tiểu đường type 2);
37.Orencia (trị viêm đa khớp, thấp khớp);
38.Oxynox (thuốc giảm đau chuyên dụng);
39.Pradaxa (dành cho bệnh nhân từng phẫu thuật thay khớp hoàn toàn);
40.Prevenar 13 (vaccine ngừa phế cầu khuẩn);
41.Procoralan (trị rối loạn nhịp tim);
42.Relistor (dành cho bệnh nhân điều trị giảm nhẹ);
43.Revlimid (trị u tủy, ung thư tủy xương);
44.Revolade (dành cho bệnh nhân cắt bỏ lá lách);
45.Roactemra (viêm đa khớp, thấp khớp);
46.Stelara (trị vảy nến);
47.Symbicort (trị hen suyễn);
48.Thalidomide (trị đa u tủy xương);
49.Thelin (dùng cho bệnh nhân cao huyết áp);
50.Toctino (trị viêm da);
51.Tracleer (dành cho bệnh nhân cao huyết áp);
52.Tysabri (trị bệnh đa xơ cứng);
53.Tyverb (điều trị ung thư vú);
54.Valdoxan (thuốc chống trầm cảm);
55.Vimpat (trị động kinh);
56.Volibris (trị cao huyết áp);
57.Xarelto (chống rối loạn tim mạch);
58.Xyrem (trị rối loạn giấc ngủ);
59.Zypadhera (trị tâm thần phân liệt).
Đằng sau “tử dược” Mediator: Những quả bom nổ chậm
Ngoài Mediator vẫn còn nhiều loại dược phẩm khác tiềm tàng nguy cơ gây ra những tác dụng phụ rất nghiêm trọng đang được lưu hành. Mỗi năm, phản ứng phụ từ thuốc giết chết 18.000 người và làm 130.000 người khác phải nhập viện tại Pháp, theo tờ L’Express. Những quả bom nổ chậm này, điển hình là Mediator, lẽ ra có thể được tháo ngòi nếu những cảnh báo về chúng được xem xét nghiêm túc hơn. Trong nhiều trường hợp, “chuông báo động” được gióng lên khá trễ và đến khi loại dược phẩm nguy hại bị rút khỏi thị trường thì đã để lại hậu quả nghiêm trọng. Thuốc kháng viêm Vioxx do Msd Chibret sản xuất, có tác dụng phụ gây nguy cơ nhồi máu cơ tim, bị các chuyên gia cho rằng đã làm 27.000 người chết tại Mỹ trước khi bị cấm vào năm 2004.
Với hệ thống bảo hiểm xã hội rất chu đáo, người Pháp nổi tiếng về việc… thích uống thuốc. Kết quả là mỗi năm hoá đơn thuốc men tại Pháp lên đến 27 tỉ euro, theo tờ France Soir. Rất nhiều bệnh nhân, thậm chí một số bác sĩ, dường như quên rằng tất cả các loại thuốc đều có phản ứng phụ. Khi bệnh nhân bị “mờ mắt” bởi quảng cáo và các bác sĩ bị ràng buộc bởi các hãng dược thì các loại thuốc “lợi bất cập hại” sẽ được sử dụng vô tội vạ.
Theo báo cáo của Uỷ ban Điều tra Thượng viện, Cơ quan An ninh sản phẩm y tế (Afssaps) được hỗ trợ tài chính rất nhiều từ các hãng dược. Afssaps chính là nơi cấp giấy phép lưu hành cho các loại dược phẩm. Một khi “đầu đã xuôi”, thuốc được bày bán, kê toa, thì tình hình trở nên khá an toàn đối với các hãng dược vì các cơ chế kiểm tra tính hiệu quả của thuốc và nguy cơ tác dụng phụ vẫn chưa được siết chặt tại Pháp.
Ngoài ra, chi phí những chương trình đào tạo y học chuyên sâu bắt buộc tại Pháp được chi trả 98% bởi các hãng dược. Các bác sĩ vì thế khó tránh việc bị “trói tay trói chân”. Cùng chung cảnh ngộ là các tạp chí y khoa. Những chuyên san hoàn toàn độc lập với ngành dược phẩm tại Pháp hiện chỉ có Pratiques và Prescrire. Trong đó, Prescrire là nơi đầu tiên đăng tải thông tin về Mediator. Còn lại, các tờ khác đều được các hãng dược “rót” tiền quảng cáo, đặt báo dài hạn với số lượng lớn đều đặn. Khi cuốn sách viết về tác hại của dược chất benfluorex trong “tử dược” Mediator của bác sĩ Irène Frachon được phát hành, tờ Quotidien du Médecin đã cho đăng ngay một bài quảng cáo của Tập đoàn Servier nhằm chối bỏ mọi liên quan giữa thuốc này với những ảnh hưởng đến van tim.
10 loại thuốc bị cảnh báo của Prescribe
Từ “danh sách đen” gần đây của Prescrire, báo L’Express đã nhờ giáo sư Jean-Paul Giroud của Viện Y học quốc gia (Pháp) thẩm định lại và đưa ra 10 loại thuốc nên cấm lưu hành:
1.Actos (sản phẩm của hãng Takeda): có chứa glitazones, một dược chất mới nhằm chữa trị bệnh tiểu đường type 2. Tác dụng phụ: gây phù nề, tổn hại xương (ở phụ nữ), suy tim cũng như bị nghi gây ung thư bàng quang. Trên thị trường trước đây có thuốc Avandia của GlaxoSmithKline (GSK) cũng chứa chất này. Từ ngày 3.11.2010, Avandia đã bị Afssaps cấm lưu hành trong khi Actos vẫn “an toàn”;
2.Adartrel (GSK): thuốc thường được dùng cho bệnh nhân Parkinson, gây buồn nôn, ảo giác, thậm chí ngất xỉu. Các chuyên gia nghi ngờ Adartrel làm bệnh trầm trọng hơn, sau một giai đoạn đầu tiên tạm thuyên giảm;
3.Di-Antalvic (Sanofi-Aventis): thuốc giảm đau. Di-Antalvic là sự kết hợp giữa dextropropoxyphène và paracétamol, lưu hành trên thị trường từ 40 năm qua. Thuốc này được cho là giảm đau hiệu quả hơn các loại dược phẩm chỉ chứa paracetamol. Tuy nhiên công dụng này trên thực tế chưa từng được chứng minh trong khi những nguy cơ khi sử dụng quá liều có thể rất nghiêm trọng, từ rối loạn tâm lý, hệ tim mạch cho đến ngưng tim. Anh, Thuỵ Điển và Thuỵ Sĩ đã cấm thuốc này từ nhiều năm nay. Mỹ từ ngày 19.11.2010. Riêng Pháp dự định sẽ rút sản phẩm này khỏi thị trường vào tháng 9.2011;
4.Hexaquine (Gomenol): thuốc trị chứng co cơ. Hexaquine chứa quinine (ký ninh), dược chất giúp chữa bệnh sốt rét khá hiệu quả nhưng lại dẫn đến nguy cơ loạn nhịp tim, giảm tiểu cầu, sốc thuốc do dị ứng. Tại Mỹ, loại thuốc này đã không được kê toa chữa chứng co cơ từ năm 1995 sau hàng trăm ca tử vong vì phản ứng phụ;
5.Intrinsa (Warner Chilcott): thuốc dành cho những phụ nữ không còn “hưng phấn” sau khi cắt bỏ buồng trứng và tử cung. Intrinsa không được lưu hành ở Mỹ vì bị đánh giá thiếu hiệu quả có nhiều tác dụng phụ: tăng nam tính (mọc nhiều lông, giọng khàn), nổi mụn, ảnh hưởng chức năng gan và tim mạch, tăng cân;
6.Ketek (Sanofi-Aventis): thuốc trị nhiễm trùng hệ hô hấp. Những nghiên cứu ở châu Âu năm 2006, 2007 cho thấy thuốc này thường dẫn đến chứng nhược cơ, mất nhận thức, rối loạn thị giác, nhịp tim và ảnh hưởng gan;
7.Nexen (Thérabel Lucien Pharma): thuốc giảm đau cho bệnh nhân bị thoái hoá khớp và đau bụng do hành kinh. Nexen có thể làm tổn hại gan trầm trọng. Phần Lan, Tây Ban Nha đã cấm lưu hành từ năm 2002, Ireland cấm từ năm 2007;
8.Vastarel (Servier): thuốc chỉ định cho người bị chóng mặt, ù tai, nhói tim, rối loạn thị giác. Được lưu hành từ 40 năm qua, loại thuốc này rất hay được kê toa cho các bệnh nhân cao tuổi. Từ 10 năm nay, rất nhiều trường hợp phản ứng phụ được ghi nhận: run rẩy, ảnh hưởng nhiều đến việc di chuyển, biểu hiện của bệnh Parkinson;
9.Zyprexa (Lilly France): chỉ định cho bệnh nhân tâm thần phân lập. Chính hãng Lilly France thừa nhận năm 2003 rằng Zyprexa có thể gây béo phì nặng và nguy cơ tiểu đường;
10.Zyban (GSK): dành cho người muốn cai thuốc lá. Tác dụng của Zyban bị đánh giá không cao trong khi thuốc này có thể gây ra cao huyết áp;
Nhiều loại thuốc bị cảnh báo cũng có mặt ở Việt Nam:
Qua tìm hiểu của Thanh Niên, trong số những loại thuốc do các chuyên gia Pháp cảnh báo, có những loại không còn bán tại Vieetj Nam, có loại còn nhưng chỉ là hàng xách tay và cũng có loại đang được sản xuất và lưu hành. Thuốc Zyprexa (hoạt chất Olanzapine) được chỉ định điều trị bệnh tâm thần. Theo các dược sĩ, tác dụng ngoại ý của thuốc này là làm tăng trọng. Vastarel (hoạt chất trimetazidine), các nhà máy dược trong nước có sản xuất nhưng chưa nghe nói về phản ứng phụ run rẩy khi dùng. Zyban (hoạt chất bupropion) cũng được lưu hành trong nước, dùng theo toa chỉ định của bác sĩ. Di-Antalvic có mặt ở VN gần 30 năm nay và nhiều đơn vị trong nước đang sản xuất.
Hiện thị trường VN ít sử dụng thuốc Adartrel trị bệnh Parkinson, chỉ có hàng phi mậu dịch và chưa có công ty nào nhập về. Thuốc Actos (hoạt chất Pioglitazole) thì có rất nhiều biệt dược đang lưu hành, trong đó Avandia trước đây đã bị cấm tại Pháp. Nexen (hoạt chất Naproxen) trị đau khớp, chấn thương... VN có sản xuất, nhưng ít được sử dụng.
Đình chỉ lưu hành 3 loại thuốc không đạt chất lượng
Sở Y tế TP. Hồ Chí Minh vừa có thông báo đình chỉ lưu hành 3 loại thuốc không đạt tiêu chuẩn chất lượng. Đó là thuốc hoàn cứng Vị thống kim đơn, hộp 10gói x 4g, số lô 032010, HD: 04.2012, SĐK: V-149-H12-10 do Cơ sở sản xuất đông dược Vạn An Dược Hãng (Bình Dương) sản xuất do không đạt tiêu chuẩn chất lượng về chỉ tiêu giới hạn nhiễm khuẩn. Thuốc hoàn cứng Thấp thần phương, chai 30g, số lô 04, HD: 180812, SĐK: V1398-H12-10 do Doanh nghiệp tư nhân bào chế đông dược Thiên Thảo sản xuất do không đạt tiêu chuẩn chất lượng về chỉ tiêu giới hạn nhiễm khuẩn. Thuốc hoàn mềm Ngưu hoàng hoàn, hộp 10 hoàn, số lô 028010, HD: 0811, SĐK: VND-3689-05 do Cơ sở Nhuận Đức Đường (Tiền Giang) sản xuất do không đạt tiêu chuẩn về chất lượng độ đồng đều khối lượng (Sức khỏe & đời sống 19/2).