|
Một số bệnh phổi do nhiễm ký sinh trùng ở người (Phần 2-còn nữa)
Tiếp theo Phần 1
Bệnh sán máng phổi (Pulmonary schistosomiasis)
Gánh nặng của bệnh sán máng là rất lớn, ước tính có khoảng 200 triệu người nhiễm bệnh trên toàn cầu,chủ yếu ở các nước có thu nhập thấp và trung bình như châu Phi, một số khu vực châu Á và Nam Mỹ. Schistosoma spp. có thể gây ra bệnh phổi cấp tính hoặc mãn tính hoặc phổi có thể bị ảnh hưởng trong cơn sốt Katayama (hình thức bênh sán máng cấp tính với các triệu chứng từ 3-6 tuần kể từ nhiễm trùng đầu tiên do Schistosoma (S) mansoni, S. japonicumhay hiếm hơn là S. haematobium. Pha cấp của bệnh sán máng thường dễ nhầm lẫn với với các bệnh có sốt khác, nhất là khi các du khách đến từ vùng không hề có miễn dịch với bệnh. Sốt Katayama nên cân nhác và chẩn đoán khi có sốt kèm theo tăng BCAT). Bệnh sán máng cấp tính và mãn tính gây ra các tổn thương dạng nốt ở phổi và bệnh có khả năng liên quan đến trứng do sán trưởng thành đẻ trong quá trình di chuyển ở giai đoạn mạn tính. Ngoài ra, các nốt trong phổi hình thành trong cơn sốt Katayama (hội chứng) là hậu quả của phản ứng miễn dịch - dị ứng toàn thân. Sự phân biệt giữa bệnh sán máng cấp tính và mạn tính dựa trên một khung thời gian cắt ngang tùy ý là 10-12 tuần kể từ thời điểm phơi nhiễm. Bệnh sán máng cấp tính (sốt Katayama) thường xảy ra ở những người du lịch không có miễn dịch và kèm theo sốt, khó chịu,mệt mỏi, nhức đầu, ho, đau bụng và nổi mề đay. Bệnh này có liên quan đến sự di chuyển, trưởng thành và đẻ trứng của ấu trùng sán máng và các phản ứng miễn dịch sau đó. Các biểu hiện trên phim X-quang có thể bao gồm các nốt đặc trưng, các vùng mờ dạng kính mờ và các tổn thương giống như khối u. Việc chẩn đoán dựa vào việc tìm thấy trứng sán máng trong mẫu phân, nước tiểu hoặc sinh thiết mô. Tuy nhiên, trong sốt Katayama, chẩn đoán cũng có thể được xác định bằng PCR huyết thanh nếu mẫu nước tiểu và phân âm tính với trứng Schistosomaspp. Một trong những biểu hiện của bệnh sán máng là tăng áp động mạch phổi do sán máng (Schistosomiasis-induced pulmonary arterial hypertension_SchPAH). SchPAH được coi là một bệnh toàn cầu do tỷ lệ mắc bệnh sán máng cao, với tỷ lệ 5% trong số những người bị nhiễm sán máng mãn tính và 5-30% ở bệnh nhân mắc bệnh sán máng gan-lách thứ phát do S. mansoni. Một nghiên cứu khác cho thấy SchPAH chiếm 30,8% trong tất cả trường hợp tăng áp động mạch phổi ở các khu vực lưu hành dịch. 
Hình 3c. Cơ chế tăng áp động mạch phổi do nhiễm sán máng Schistosoma spp. (SchPAH)
Trong một nghiên cứu hồi cứu từ Trung Quốc, chỉ có 10 trong số 18.829 (0,053%) người mắc bệnh sán máng bị chẩn đoán tăng áp động mạch phổi bằng siêu âm tim. Các nguyên nhân ký sinh trùng khác gây tăng áp động mạch phổi bao gồm giun chỉ W. bancrofti, sán lá gan nhỏ Clonorchis sinensis ở Đông Nam Á và sán dây chó Echinococcusspp. Có ba giải thích khả dĩ cho sự phát triển của SchPAH: (i) Trứng sán máng làm tắc mạch máu phổi, trứng sán máng gây tắc nghẽn mạch máu do tình trạng tăng áp tĩnh mạch cửa-phổi và sự phát triển của viêm mạch máu. Bệnh sán máng phổi thường gặp hơn ở S. mansoni và S. japonicum. Một số nghiên cứu phát hiện rằng S. japonicum gây SchPAH nhẹ hơn so với S. mansoni trong mô hình động vật, được cho là do sự phân bố đồng đều của trứng S. japonicum so với sự phân cụm của trứng S. mansoni. Trong một nghiên cứu thực nghiệm, S. japonicum tạo ra các u hạt nhỏ hơn 35 lần so với các u hạt do S. mansoni gây ra do tình trạng viêm type 2 giảm đáng kể. 
Chú thích: 1PAH (pulmonary arterial hypertension): tăng áp động mạch phổi
2HSS (Hepatosplenic schistosomiasis): một dạng bệnh của bệnh sán máng ảnh hưởng đến gan và lách Cơ chế gây bệnh của SchPAH được cho là liên quan đến sự hình thành mạch máu mới. Do đó, việc ức chế sự hình thành mạch bằng cách sử dụng bevacizumab đã được liên kết với việc giảm sự hình thành mạch trong mô hình chuột. Các phương pháp điều trị hiện tại đối với SchPAH dựa vào các chất ức chế đường nitric oxide (NO) như các chất ức chế phosphodiesterase loại 5 (sildenafil và tadalafil), các chất kích thích guanylyl cyclase hòa tan (riociguat), chất đối kháng receptor endothelin (bosentan, ambrisentan và macitentan) và chất tương tự prostacyclin (epoprostenol, treprostinil, iloprost và chất kích thích receptor IP không phải prostanoit selexipag, như mô tả chi tiết bởi SIBOMANA và cộng sự. Kinh nghiệm cho thấy rằng các chất ức chế phosphodiesterase loại 5 cải thiện các triệu chứng và cũng có thểtăng tỷ lệ sống. Các bệnh phổi liên quan đến sán máng khác bao gồm tràn khí màng phổi tự phát, tràn khí màng phổi với dày màng phổi và tổn thương phổi dạng u nang. Bệnh sau có thể cấp tính ở trường hợp du khách hoặc mãn tính ở những cư dân trong vùng lưu hành bệnh. Một u nang phổi có hoạt động chuyển hóa cao khi sử dụng PET/CT với 18F-fluorodeoxyglucose đã được mô tả liên quan đến bệnh sán máng. Tràn dịch màng phổi liên quan đến bệnh sán lá phổi Paragonimusspp. Các loài phổ biến nhất liên quan đến bệnh sán lá phổi là Paragonimus westermani, P. miyazakii, P. mexicanus và P. skrjabini. Sau khi bị nuốt vào cơ thể, ký sinh trùng sán lá phổi trưởng thành đi qua nhiều cơ quan hoặc mô và sau đó đến các mô phổi từ ruột non. Bệnh sán lá phổi có thể liên quan đến các tổn thương dạng nang và các nốt sần và 20% bệnh nhân có thể có các tổn thương do sán lá phổi không triệu chứng. Tràn dịch màng phổi đã được mô tả cụ thể với bệnh sán lá phổi và được báo cáo ở 40-70% bệnh nhân và có liên quan đến tăng BCAT. Tuy nhiên, bệnh sán lá phổi cũng có thể gây ra các nốt, thâm nhiễm và các khoang rỗng (Hình 4). Dấu hiệu hình ảnh học phổ biến nhất là tràn dịch màng phổi liên quan đến sự thâm nhiễm lớn của BCAT. Mặc dù biểu hiện kinh điển của nhiễm sán lá phổi là tổn thương phổi dạng khoang, nhưng chỉ có 5% bệnh nhân có dấu hiệu này. Một nghiên cứu về chụp cắt lớp vi tính ngực cho thấy các đám mờ dạng nốt (56,4%) và dấu vết di chuyển của sán (18,1%). Một biểu hiện hiếm gặp của hội chứng Loeffler cũng đã được mô tả với P. westermani. Chẩn đoán bệnh sán lá phổi dựa vào việc phát hiện trứng sán Paragonimusspp. trong phân, đờm, dịch rửa phế quản-phế nang hoặc dịch màng phổi, nhưng điều này chỉ thấy ở thiểu số (11,7%) bệnh nhân. Phương pháp huyết thanh học được sử dụng rộng rãi nhất để chẩn đoán nhiễm sán lá phổiParagonimusspp. là miễn dịch ELISA gián tiếp có phản ứng chéo đáng kể với bệnh sán máng, sán lá gan lớn Fasciola spp. và sán lá gan nhỏ. Mô bệnh học của mô phổi có thể biểu hiện tình trạng viêm u hạt mãn tính với nhiều trứng ký sinh trùng phù hợp với bệnh sán lá phổi (Hình 5). Việc điều trị dựa vào việc sử dụng Biltricide uống với liều 25 mg/kg x3 lần/ngày trong 3 ngày. Phương pháp phẫu thuật cũng được cân nhắc ở những bệnh nhân mắc bệnh nặng ở màng phổi hoặc bệnh nặng ở cả màng phổi và mô phổi. 
Hình 4 (a) Hình chụp X-quang ngực theo hướng từ sau ra trước cho thấy có sự bất thường của rốn phổi bên phải ở một bệnh nhân nhiễm sán lá phổi Paragonimusspp.
(b) Hình ảnh CT cho thấy có một khu vực mô phổi bị hoại tử và phế quản bị tắc nghẽn ở phân đoạn trước của thùy trên bên phải.
Điều này có thể là dấu hiệu của các loại nhiễm trùng hoặc viêm như lao, actinomycosis, viêm phổi và ít có khả năng là ung thư phổi ở cùng bệnh nhân nhiễm sán lá phổi Paragonimus spp.
(c) Hình chụp CT ngực theo dõi sau 8 tháng điều trị bằng kháng sinh và liệu pháp kháng nấm không thấy dấu hiệu
cải thiện và bệnh nhân có dấu hiệu hình thành khoang trong phổi.

Hình 5.Biểu hiện mô bệnh học của mẫu mô cho thấy sự phát triển viêm u hạt mãn tính với nhiều trứng
ký sinh trùng phù hợp với bệnh sán lá phổi Paragonimiasis spp.
Bệnh amip phổi (Pulmonary amebiasis) Entamoeba histolytica là tác nhân gây ra bệnh amip và gây ra các biểu hiện trong ruột và ngoài ruột bao gồm cả amip gan và amip phổi. Ước tính có 7 - 20% bệnh nhân mắc amip gan và 2 - 3% bệnh nhân mắc bệnh nghiêm trọng và có tính xâm lấn cũng bị tràn dịch màng phổi, áp xe phổi hoặc u nang phổi. 
Hình Áp xe phổi do amip Entamoeba histolytica
Amip cũng đã được phát hiện gây ra bệnh mủ màng phổi và tắc nghẽn động mạch cảnh. Bệnhnang sán phổi (Pulmonaryhydatiddisease) Các ấu trùng của loài sán dây Echinococcus spp., đặc biệt là loài E. granulosus, là tác nhân gây ra bệnh nang sán. Bệnh này đã được báo cáo xuất hiện ở Nam Mỹ, khu vực Địa Trung Hải, Trung Đông, châu Phi cận sa mạc Sahara, Nga và Trung Quốc và tỷ lệ lưu hành bệnh được ước tính lên đến 79 trường hợp trên 100.000 người. Bệnh nang sán phổi chiếm 20-30% trong số các ca bệnh nang sán. Biểu hiện chính của bệnh được phát hiện ngẫu nhiên trên các hình ảnh chụp X-quang. Tuy nhiên, bệnh nhân có thể trải qua các triệu chứng như ho, ho ra máu, đau ngực hoặc tràn khí màng phổi. Các hình ảnh chụp X-quang của bệnh nang sán phổi khác nhau giữa E. granulosus và E. multilocularis. Bệnh nang sán do E. granulosus,khi các nang chưa bị vỡ, sẽ tạo ra các nốt hoặc khối có bờ mịn và không bị vôi hóa. Ngược lại, loài E. multilocularis gây ra bệnh Echinococcosis phế nang (Alveolar Echinococcosis) và trên hình ảnh chụp X-quang hoặc CT scan, bệnh này xuất hiện dưới dạng các nốt hoặc khối có hình dạng tạo thùy và có sự vôi hóa. Các đặc điểm chính của nang sán trên hình ảnh X-quang bao gồm: dấu meniscus, dấu bán nguyệt, dấu Cumbo, dấu vỏ hành tây, dấu hoa súng và dấu khối trong khoang. Một trong những dấu hiệu kinh điển trên hình ảnh X-quang của nang sán là một vùng sáng tròn rõ ràng trong phổi, có hoặc không có sự vôi hóa(Hình 6). Bệnh nang sán phổi có thể bị nhiễm trùng thứ phát và trên hình ảnh X-quang ngực có thể xuất hiện u nang và mức dịch khí (Hình 7). 
Hình 6.Chụp X-quang phổi thông thường cho thấy có
một vùng sáng tròn rõ ràngnằm ở vùng thấp bên trái
của phổi.
| 
Hình 7.Hình ảnhX-quang ngực nghiêng cho thấy mức dịch
khí bên trong một nang sán đã tồn tại từ trước gợi ý
nhiễm trùng chồng lấn.
|
Điều trị dựa vào phẫu thuật cắt bỏ u nang có hoặc không kèm cắt bỏ mô phổi. Trong một đánh giá có hệ thống, việc sử dụng phẫu thuật nội soi lồng ngực có hỗ trợ bằng video một cổng để phẩu thuật loại bỏ có liên quan đến tỷ lệ biến chứng chung là 9,35% và không có báo cáo tái phát. Nhìn chung, việc loại bỏ nang sán phổi bằng phẫu thuật có tỷ lệ mắc bệnh và tử vong thấp. Một nghiên cứu trên 12 bệnh nhân mắc bệnh nang sán phổi cho thấy tỷ lệ chữa khỏi là 72% và không có sự thay đổi ở 18% bệnh nhân sử dụng albendazole (800 mg/ngày) trong bốn đợt, mỗi đợt kéo dài 28 ngày, sau đó là 14 ngày ngưng thuốc. Việc sử dụng albendazole không được khuyến nghị trước phẫu thuật do làm mỏng vỏ nang nhưng được sử dụng sau phẫu thuật như liệu pháp hỗ trợ phẫu thuật và có liên quan đến tỷ lệ tái phát cao là 25%. Trong một nghiên cứu, liệu pháp albendazole trước phẫu thuật có liên quan đến việc giảm độ bền kéo của màng bảo vệ ngoài cùng của các nang sán. 
| 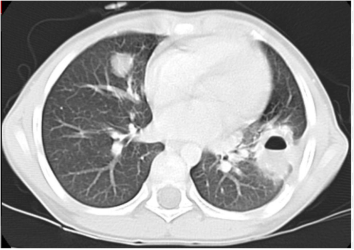
| Hình 8. Tổn thương phổi do sán dây Echinococcusspp. |
Một nghiên cứu cho thấy tỷ lệ tái phát là 18,7% đối với những người không dùng albendazole so với 4,16% ở những người đã dùng albendazole trước và/hoặc sau phẫu thuật gan. Mặt khác, trẻ em đặc biệt là những trẻ có u nang nhỏ, u nang non hoặc u nang có nang con có thể đáp ứng tốt với điều trị bằng albendazole mà không cần phẫu thuật. Chọc hút nang sán bằng kim với liệu pháp chống ký sinh trùng trước và sau khi hút cũng được khuyến khích. Một trong các kỹ thuật điều trị u nang sán là sử dụng kỹ thuật hút chân không nội soi để lấy các chất chứa trong nang, tiêm chất diệt sán và hút lại (Percutaneous Aspiration, Injection of Scolicidal Agent and Re-aspiration_PAIR). Kỹ thuật này đã được áp dụng thành công, nhưng có lưu ý về nguy cơ liên quan đến kỹ thuật PAIR đối với các u nang phổi.
Còn nữa à Tiếp theo Phần 3
|

