 |
| Strongyloides stercoralis( ảnh: http://www.smittskyddsinstitutet.se) |
Làm thế nào để hạn chế phản ứng chéo và dương tính giả trong xét nghiệm ELISA chẩn đoán bệnh giun lươn (Strongyloides stercoralis)
Strongyloides stercoralis: Một bệnh giun truyền qua đất đang bị lãng quênLoài giun tròn mà được các nhà nghiên cứu quan tâm và tìm hiểu sâu nhất và đây cũng là loài giun lưu hành và phổ biến, cụ thể Ascaris lumbricoides, Trichuris trichiura và các giun móc (Ancylostoma duodenale và Necator americanus). Một ước tính cho biết khoảng 1-2 tỷ người trên khắp thế giới bị nhiễm một trong số các loại giun tròn đường ruột, gây ra một gánh nặng toàn cầu lên đến 39 triệu năm đời sống bệnh tật (disability-adjusted life years_DALYs), tương tự như sốt rét hoặc lao. Tuy nhiên, các bệnh giun truyền qua đất cũng được xem là các căn bệnh nhiệt đới bị lãng (neglected tropical diseases_NTDs). Có lẽ bệnh bị lãng quên nhất là bệnh giun lươn do Strongyloides stercoralis, ước tính nhiễm 30-100 triệu người trên các vùng nhiệt đới và ôn đới trên toàn cầu. Với bài viết của nhóm tác giả Robert A Schwartz (khoa da và bệnh học của Trung tâm y học dự phòng của đại học y khoa UMDNJ-New Jersey) đã đề cập đến các khía cạnh dựa trên những kinh nghiệm về bệnh ký sinh trùng nói chung và bệnh giun lươn nói riêng cho biết viêm đại tràng do giun lươn Strongyloides là một căn bệnh có thể dễ chữa khỏi nhưng có thể dẫn đến bệnh viêm loét đại tàng có thể nguy cơ tử vong do không điều trị. Một vấn đề quan trọng là cần khuyến cáo các bác sĩ nên thận trọng và chú ý các dấu chứng và triệu chứng tiêu hóa dễ nhầm lẫn với viem đại tràng loét (ulcerative colitis). Viêm đại tràng do Strongyloides nên đưa vào chẩn đoán phân biệt với các bệnh lý tiêu hóa khác, kể cả viêm đại tràng loét. Việc chẩn đoán và phát hiện các bệnh giun sán nói chung và bệnh giun lươn nói riêng hiện nay dường như chưa có thống nhất giữa các quan điểm, bởi các chuẩn vàng trong chẩn đoán hiếm khi xác định được, nếu có chỉ < 10% mà thôi, do vậy các thầy thuốc thường dựa vào các các tiêu chuẩn lâm sàng và cận lâm sàng khác nhau để quy kết chẩn đoán:Dưới đây có thể được xem như một sơ đồ gồm các xét nghiệm và công cụ chẩn đoán cho bệnh giun lươn một cách chi tiết cho tất cả các tuyến có thể thực hiện từ thô sơ đến hiện đại:Chẩn đoán cận lâm sàngXét nghiệm máu thường quy -Trong công thức máu toàn phần thường cho thấy một thông số bạch cầu bình thường trong cả giai đoạn cấp và mạn tính của bệnh giun lươn. Bạch cầu có thể tăng trong trường hợp nhiễm trùng giun lươn nghiêm trọng; -Tăng bạch cầu ái toan 10-40% thường gặp trong giai đoạn cấp; có thể tăng lên đến 75-80%. Tăng bạch cầu ái toan có thể cũng xảy ra trong nhiễm trùng mạn tính, mặc dù có thể xuất hiện hoặc tăng lên từng đợt và cũng có thể phát hiện thấy trong quá trình bệnh diễn tiến nặng; -Nồng độ immunoglobulin E (IgE) toàn phần trong huyết thanh có thể tăng cao; -Nhiễm trùng nặng có thể liên quan đến thiếu máu, giảm tiểu cầu và tỷ lệ hoặc thời gian prothrombin time (PT) kéo dài vì nồng độ các chất đông máu giảm; -Cấy máu trong tất cả trường hợp bệnh nhân nhiễm giun lươn Strongyloides có thể nghi ngờ vì bệnh sinh viêm ruột thường đồng nhiễm; Xét nghiệm phân tìm trứng và ký sinh trùng . -Chẩn đoán xác định lệ thuộc vào xem dưới kính hiển vi phát hiện ấu trùng giun lươn S. stercoralis larvae trong phân. Ấu trùng tương tự như giun móc nhưng có thể phân biệt bởi các khaong miệng của chúng có phần khác nhau; -Trứng hình như chưa bao giờ nhìn thấy trong bệnh giun lươn trừ khi có tiêu chảy nặng xảy ra; -Một số mẫu phân tươi có thể đòi hỏi để xét nghiệm trước khi kết quả xét nghiệm tìm thấy. Ít nhất 3 lần xét nghiệm riêng biệt vào các ngày khác nhau và độ nhạy khi đó khoảng chừng 70-80%. -Các mẫu phân có thể tập trung bằng sulphate kẽm trước khi xét nghiệm để tăng độ phục hồi của ấu trùng. Một biện pháp cải tiến trên thạch và plate là có ưu điểm hơn các kỹ thuật khác trong xét nghiệm mẫu phân; -Dịch tá tràng có thể trích lấy hoặc xét nghiệm bằng thử nghiệm Entero-Test, hoặc phương pháp “string capsule”. Test này mang lại tỷ lệ tái hồi của ấu trùng cao hơn trong xét nghiệm phân. Các xét nghiệm huyết thanh chẩn đoán -Mặc dù các xét nghiệm huyết thanh học là cho độ nhạy cao nhất trong chẩn đoán bệnh giun lươn (Se: 84-92%), nó lại không đặc hiệu và cho phản ứng chéo với một số loài giun tròn khác khi nhiễm đồng thời là có thể rất cao. Do vậy, phân tích vi thể là cần thiết để xác định chẩn đoán; -Các xét nghiệm huyết thanh thường sử dụng trong chẩn đoán bệnh giun lươn gòm có xét nghiệm Enzyme immunoassay (EIA) và miễn dịch liên kết enzyme enzyme-linked immunosorbent assay (ELISA). Tuy nhiên, điều tra về phân và huyết thanh được tiến hành trong một cộng đồng tại khu vực Peruvian Amazon cho thấy ELISA có giá trị tiên đoán âm tính (NPV) lên đến 98% và đây xem như là một test sàng lọc cho bệnh giun lươn rất tuyệt vời. Một nghiên cứu về EIA kháng thể IgG kháng giun lươn (anti-Strongyloides IgG EIA) cho thấy quy trình thực hiện dễ làm và nhanh cho kết quả. Đây có thể là một lựa chọn tốt khi xét nghiệm phân cho kết quả âm tính, cũng như trên những bệnh nhân suy giảm miễn dịch (Bon và cs., 2010) -Thử nghiệm ngưng kết hạt gelatine (Gelatin particle agglutination test_GPAT) và ELISA coh kết quả được đánh giá trong nhiều vùng lưu hành bệnh tại Thái Lan. Trong công trình nghiên cứu này thì GPAT được điều chỉnh và có tính thực hành trong sàng lọc bệnh giun lươn hơn là phương pháp kinh điển ELISA. -Thường thiết lập chẩn đoán và xác định để chữa khỏi bệnh giun lươn là một lĩnh vực rất khó xác định ngưỡng kháng thể đặc hiệu cho Strongyloides, kháng thể này có thể dùng để theo dõi điều trị và diễn tiến bệnh giun lươn. Chúng có thể chỉ ra sự chuyển đổi huyết thanh sang tính trạng âm tính (negative serostatus) sau khi điều trị thành công. Các chẩn đoán hình ảnh thường áp dụng-Nhiễm trùng toàn thên có liên quan đến các thử nghiệm có thể quan sát bằng các đánh giá chẩn đoán hình ảnh. -Thâm nhiễm mô kẻ hoặc phế nang hoặc tràn dịch màng phổi có thể nhìn thấy trên phim chụp phổi thẳng; -Nhiễm trùng nghiêm trọng có thể liên quan đến mất chất niêm mạc, sự xơ cứng, hẹp các ống như đã mô tả trên phim chụp X quang. -Trong các trường hợp nhiễm trùng cấp tính hoặc mạn tính, sinh thiết da thường không cần thiết cũng không đủ để chẩn đoán vì ký sinh trùng hiếm khi nhìn thấy được, nghĩa là rất khó chẩn đoán. -Trong nhiễm trùng nặng, sinh thiết da có thể hữu ích vì thể ấu trùng filariform thường tìm thấy. Các mẫu bệnh phẩm từ các hình ảnh ban xuất huyết hoặc bong ra chứa nhiều ấu trùng. -Nội soi đại tràng ruột non có thể nhìn thấy nhiều tổn thương, gồm có niêm mạc bình thường, phản ứng viêm thể vừa hoặc viêm tá tràng và đại tàng nặng, đặc biệt trên những bệnh nhân suy gimar miễn dịch; -Chọc lấy dịch tủy sống đánh giá có thể có ích trong trường hợp bệnh lý có liên quan đến tổn thương thần kinh trung ương; Trong nhiễm trùng nặng, xét nghiệm đờm và dịch rửa phế quản phù hợp cho chẩn đoán nhất. Các xét nghiệm về mặt mô học-Sinh thiết da thường có ích trong nhiễm trùng nặng trên bệnh nhân. Các ấu trùng có thể nhìn thấy trên tất cả mức độ viêm da hoặc các lớp bì. Các thử nghiệm khác gồm phù, thoát mạch hồng cầu và tế bào lympho trong lớp bì nông. Ấu trùng có kích thước từ 9-15 µm. Chúng chứa một ống tiêu hóa; -Các xét nghiệm mô học xác định ấu trùng trong 71.4% số ca suy giảm miễn dịch thông qua sinh thiết tá tràng. Do đó, ngoài xét nghiệm phân nội soi và sinh thiết sẽ là các công cụ chản đoán quan trọng; -Sinh thiết tá tràng hoặc hỗng tràng coh thấy ấu trùng trong lớp áo “lamina propria”, ở đó chúng làm cho da phù lên, thâm nhiễm tế bào, phì đại vi nhung mao, thậm chí xơ hóa do nhiễm trùng diễn trong thời gian dài. Như thế, trong một số tình huống, đứng trước ca bệnh nghi ngờ giun lươn, duy chỉ có xét nghiệm ELISA và công thức máu, biểu hiện lâm sàng không rõ ràng, hay nói đúng hơn là rất mơ hồ thì chúng ta nên thận trọng một số trường hợp có thể nhiễm chéo hay phản ứng chéo (cross-reactive) với các loại giun sán khác? Sau đây là một số nghiên cứu của các chuyên gia về bệnh ký sinh trùng đã nghiên cứu sâu về phản ứng chéo của giun lươn với một số con giun tròn khác, cũng như đề xuất các biện pháp nhằm khắc phục hoặc nâng cao tính nhạy và độ đặc hiệu cho xét nghiệm để xác định bệnh tốt hơn.1. Chẩn đoán miễn dịch giun lươn Strongyloides stercoralis: một phương pháp làm tăng độ đặc hiệu của phản ứng ELISA gián tiếp.Một nhóm gồm các nhà nghiên cứu Conway DJ, Atkins NS, Lillywhite JE, Bailey JW, Robinson RD, Lindo JF, Bundy DA, Bianco AE đang công tác tại Trung tâm nghiên cứu bệnh ký sinh tùng của Wellcome Trust, đại học Imperial, Anh Quốc cùng tiến hành thử nghiệm này và kết quả đăng tải trên tạp chí Trans R Soc Trop Med Hyg. Thử nghiệm ELISA cho phép phát hiện với độ nhạy của immunoglobulin (Ig) G kháng lại tính chất từ ấu trùng giai đoan nhiễm của giun lươn Strongyloides stercoralis. Trong nghiên cứu này, 40/40 (100%) mẫu huyết thanh người bị giun lươn có nồng độ cao thành phần anti-S. stercoralis IgG, nhưng 30/40 (75%) huyết thanh giun chỉ và 12/40 (30%) huyết thanh giun móc cũng có nồng độ cao hơn nhóm chứng - ghi nhận từ quần thể dân đang sống tại Anh. Để cố gắng gia tăng độ đặc hiệu của thử nghiệm bằng hấp thụ khỏi phản ứng chéo của IgG, hiệu quả của giai đoạn trước khi ử huyết thanh với các phần chiết từ các loài giun tròn khác nhau cần làm rõ. Một giờ trước khi ủ với 20 micrograms/ml chất chiết của Onchocerca gutturosa hấp phụ dương tính chéo với IgG trong hầu hết các giun chỉ và giun móc, giảm tỷ lệ nồng độ IgG trên mức ngưỡng dương tính bằng cách cho hơn 1 nửa. Các kết quả sơ bộ cho thấy sự hấp phụ với các chất chiết của các giun chỉ khác hiệu quả như nhau và một số trong số IgG phản ứng chéo trực tiếp với phosphorylcholine. Các IgG phản ứng chéo trong hầu hết huyết thanh của giun móc có hiệu quả hấp phụ với 20 micrograms/ml chất chiết của giun móc Necator americanus. IgG phản ứng chéo không hiệu quả với chất chiết của giun đũa Ascaris lumbricoides. Sự hấp phụ của các IgG phản ứng chéo là một công cụ hữu hiệu để làm tăng độ đặc hiệu của phản ứng ELISA gián tiếp, để sử dụng như một công cụ chẩn đoán miễn dịch và điều tra dịch tễ học. 2. Đánh giá so sánh thử nghiệm ngưng kết phân tử gelatin (GPAT_gelatin particle agglutination Test) và thử nghiệm ELISA trong chẩn đoán bệnh giun lươnStrongyloides stercoralis là một bệnh giun tròn đường ruột, phân bố trên khắp thế giới, đặc biệt tại các vùng nhiệt đới và cận nhiệt đới. Khả năng độc nhất của nó sinh ra họi chứng tăng nhiễm và nhiễm trùng lan tỏa là độc đáo, nhất là trên những cá nhân bị suy giảm miễn dịch vì dùng liệu pháp corticoides lây dài và liều cao. Để tránh những tình trạng như thế, việc tiến hành các phương pháp nhạy và đặc hiệu cho chẩn đoán để điều trị giun sán kịp thời là việc làm cần thiết. Xét nghiệm phân cổ điển thường không đáng tin cậy để chẩn đoán bệnh giun lươn do nhiễm mật độ thấp và sự sinh sản chỉ ở mức độ thấp. Các phương pháp ký sinh trùng cải tiến, đặc biệt là kỹ thuật nuôi cấy trên thạch (agar plate culture technique_APCT), làm tăng tỷ lệ phát hiện bệnh và hiện đang được quan tâm vì đây là kỹ thuật xét nghiệm phân có độ nhạy cao nhất. Tuy nhiên, chẩn đoán phân có mặt hạn chế và việc xét nghiệm như thế đòi hỏi phải lặp lại nhiều lần (ít nhất 3 lần) để chẩn đoán được tin cậy hơn. Trong các tình huống như thế, các xét nghiệm huyết thanh đặc biệt là xét nghiệm ELISA có nhiều lợi điểm hơn phương pháp chẩn đoán về mặt ký sinh trùng, chỉ cần đến một mẫu huyết thanh là đủ. Do đó, nó được sử dụng rộng rãi như là một lựa chọn cho chẩn đoán bệnh giun lươn. Tuy nhiên, ELISA phải được thực hiện với các trang thiết bị tốt và kỹ thuật viên được đào tạo bài bản. Thử nghiệm GPAT đơn giản ,dễ thực hiện và không cần đòi hỏi trang thiết bị đặc biệt và ít tốn công sức lao động hơn. Và giá thành rẻ hơn ELISA. Nó được dùng rộng rãi như một công cụ sàng lọc một số bệnh truyền nhiễm, như phong Mycobacterum leprae, HIV, cũng như bệnh giun lươn. Trong một nghiên cứu gần đây, cấc nhà khoa học đã cho thấy APCT cho tỷ lệ mắc bệnh giun lươn ở các cộng đồng nông thôn cùng đông bắc Thái Lan cao và vượt trội chủ yếu loại Opisthorchis viverrini, chủ yếu ở các vùng này hơn 10 năm. Trong nghiên cứu đó, việc ứng dụng ELISA như một phương pháp bổ trợ cho thấy khoảng 46% số ca dương tính thêm. Do vậy, huyết thanh chẩn đoán đã trở nên một phương pháp quan trọng cho bệnh giun lươn trong các vùng lưu hành. Mục đích của công trình nghiên cứu này đánh giá khâu thực hiện và hiệu quả của kỹ thuật GPAT và ELISA trong chẩn đoán bệnh giun lươn ở người tại Thái Lan như một phương pháp tham chiếu.
Quá trình thực hienejcuar test GPAT và ELISA chẩn đoán bệnh giun lươn với tham chiếu kết quả theo kỹ thuật nuôi cấy trên thạch được đánh giá trên 459 mẫu bệnh phẩm của các đối tượng bệnh nhân từ các cộng đồng của vùng đông bắc Thái Lan có lưu hành bệnh giun lươn. Tỷ lệ mắc giun lươn trong 5 nhóm mẫu xác định bằng GPAT khác biệt giữa 29.3 -61.5% (trung bình 38.8%). ELISA và APCT, cùng tiến hành đồng thời cho tỷ lệ thấp hơn, lần lượt27.5% (khoảng 21.6 - 42.1%) và 22.7% (khoảng 12.7 - 53.8%). Bằng cách sử dụng APCT như một phương pháp chuẩn, độ nhạy của GPAT nói chung cao hơn ELISA (81 vs. 73%). Độ đặc hiệu GPAT thấp hơn ELISA (74 vs. 86%). Kết quả chỉ ra hiệu giá kháng thể GPAT có mối liên quan tuyến tính dương tính với giá trị của ELISA (OD ở 490 nm) (p < 0.05), gợi ý rằng hiệu giá kháng thể GPAT cũng phản ánh mức độ kháng thể đặc hiệu so với giá trị của ELISA. Dựa trên các đặc tính đơn giản, dễ sử dụng của kỹ thuật cũng như tỷ lệ độ nhạy và độ đặc hiệu của test được chấp nhận, GPAT mang tính thực hành trong sàng lọc bệnh giun lươn hơn là phương pháp cổ điển ELISA. Kết quả nghiên cứu trên có đươc do nhóm tác giả gồm J. Sithithaworn, P. Sithithaworn, T. Janrungsopa, K. Suvatanadecha, K. Ando, M. R. Haswell-Elkins hiện đang công tác tại khoa vi trùng lâm sàng, đại học khoa học y học, khoa ký sinh trùng, đại học y khoa Khon Kaen, Thái Lan, khoa bệnh học, bệnh viện đa khoa cảnh sát của Patumwan, Bangkok, Thailand, khoa sức khỏe động vật học, đại học Mie, Nhật Bản, khoa sức khỏe cộng đồng, đại học Queensland, Úc cùng tiến hành nghiên cứu và đăng tải kết quả trên tạp chíJournal of Clinical Microbiology. 3. Phát hiện kháng thể trên bệnh giun lươn bằng phản ứng ELISA
Nhóm tác giả gồm Yoshiya Sato1, Masahiro Takara2, Masamitsu Otsuru cùng tiến hành một nghiên cứu đánh giá phát hiện kháng thể của bệnh giun lươn bằng xét nghiệm ELISA cho biết phát hiện các kháng thể IgG chống bệnh giun lươn Strongyloides stercoralis trong huyết thanh của 29 bệnh nhân nhiễm giun lươn bằng phản ứng ELISA sử dụng chất chiết từ ấu trùng giun lươn thể S. stercoralis. Các kháng thể tìm thấy với một tỷ lệ cao về độ nhạy trên hầu hết các bệnh nhân. Tuy nhiên, các giá trị của ELISA không có liên quan đến cường độ nhiễm hoặc các khác biệt về mặt lâm sàng và thông số cận lâm sàng. Khi các giá trị của ELISA của một người nhiễm giun lươn so sánh với không bị giun lươn S. stercoralis thông qua xét nghiệm phân, có một sự khác biệt có ý nghĩa ghi nhận giữa 2 nhóm. Phản ứng chéo với nhiễm giun khác yếu hơn rõ rệt so với giun lươn Strongyloides. Người ta kết luận rằng các kháng thể có giá trị rất mạnh trên bệnh giun lươn ở người và thử nghiệm đã cung cấp một phương pháp chẩn đoán bệnh giun lươn có độ nhạy và đặc hiệu cao. 4. Miễn dịch chẩn đoán nhiễm giun lươn Strongyloides stercoralis tại Chile bằng cách sử dụng phản ứng ELISA Nhóm tác giả gồm Mercado R, Jercic MI, Torres P, Alcayaga S, Martins de Paula F, Costa-Cruz JM, Ueta MT Tất cả đang công tác tại khoa ký sinh trùng Norte, ICBM, khoa y của đại học Chile, Casilla, Santiago, Chile cùng tiến hành nghiên cứu và đăng tải kết quả trên tạp chí Rev Med Chil. Strongyloides stercoralis phân bố rộng trên khắp thế giới với một tỷ lệ lưu hành đáng quan tâm. Trên những cá nhân bị suy giảm miễn dịch thì giun lươn S. stercoralis có thể gây nên tình trạng nhiễm trùng không triệu chứng hoặc triệu chứng nhẹ với hình ảnh lâm sàng là tiêu chảy, một số ca trở thành nhiễm mạn tính. Trên các bệnh nhân suy giảm miễn dịch, bệnh có thể lan tỏa, đoi khi tử vong. Tại Chi Lê, có một số thông tin về mặt dịch tễ học của nhiễm giun lươn S. stercoralis và các kỹ thuật chẩn đoán thích hợp thường không được sử dụng. mục đích của nghiên cứu làđánh giá về các xét nghiệm ELISA trong chẩn đoán bệnh giun lươn của bệnh nhân người Chile. 10 mẫu huyết thanh từ các bệnh nhân nhiễm S. stercoralis được xác định bởi xét nghiệm phân, 66 mẫu từ các đối tượng nhiễm trùng khác do giun sán ở mô (24 nhiễm giun đũa chó, 15 nhiễm giun tóc, 11 nhiễm hydatid, 12 nhiễm sán lá gan lớn và 4 ca nhiễm ấu trùng sán lợn), 13 mẫu từ các đối tượng mắc bệnh tự miễn và 49 mẫu lấy từ người khỏe mạnh có chỉ số eosin bình thường. Kháng nguyên ELISA được chế sẵn từ chất chiết của ấu trùng filariform thu nhận của các loài giun lươn trên chuột nuôi trong la bô. Kết quả cho thấy sử dụng mật độ quan OD 0.33 UI làm giá trị ngưỡng, thì 9/10 mẫu huyết thanh cúa cá nhân nhiễm giun lươn đã dương tính với ELISA. Không thấy phản ứng chéo với các mẫu huyết thành khác trên các bệnh nhân nhiễm các loài giun sán khác, bệnh tự miễn hoặc người khỏe mạnh. Do vậy, tính đặc hiệu, giá trị dự kiến dương tính và âm tính là 100%. Kết quả này tương tự các kết quả trong y văn, công cụ xét nghiệm ELISA cho bệnh giun lươn rất hữu ích trong chẩn đoán ca bệnh lâm sàng và nghiên cứu dịch tễ học huyết thanh của loài giun tròn này tại Chile. 5. Strongyloides stercoralis: Có nhưng không nhìn thấy Bệnh giun lươn (Strongyloidiasis) là một thử thách y tế toàn cầu nghiêm trọng chưa được ước tính tại các quốc gia một cách chính xác. Các biện pháp chẩn đoán mới mong đợi cải thiện được nghiên cứu về mặt dịch tễ học và các nổ lực phòng chống cũng như dự phòng cho bệnh giun lươn và bên cạnh đó còn nhiều nghiên cứu mong muốn tìm hiểu được cơ chế của các đặc điểm lâm sàng bệnh giun lươn. Các tác giả gồm Montes, Martin trong một khảo sát đã đăng tải kết quả lên trên diễn đàn và tạp chí chuyên luận Current Opinion in Infectious Diseases cho biết mục đích của tổng quan này là nhìn nhận việc chẩn đoán bệnh giun lươn Strongyloides stercoralis thường bị chậm trễ do các bệnh nhân biểu hiện các triệu chứng tiêu hóa không đặc hiệu, mật độ ký sinh tùng trong ocw thể thấp cũng như cung lượng ấu trùng thấp nên bệnh không biểu hiện. Mặc dù một số phương pháp chẩn đoán hiện nay có thể phát hiện sự có mặt S. stercoralis, song không có một tiêu chuẩn vàng nào ghi nhận để chẩn đoán xác định. Trên các bệnh nhân suy giảm miễn dịch (bệnh lý ác tính, cấy ghép tạng, T-cell-lymphocytic virus 1 hoặc đang dùng liệu pháp corticoides), chu trình tự nhiễm có thể không kiểm tra được một số lượng lớn ấu trùng giun lươn xâm nhập Strongyloides lan rộng và gây nên hội chứng tăng nhiễm, có thể gây tử vong bệnh nhân. Bài tổng quan này nhằm ghi lại các ddiemr nổi bật các phương pháp chẩn đoán cải tiếng cho bệnh giun lươn S. stercoralis và cơ chế miễn dịch bị quy kết cho hội chứng tăng nhiễm. Các xét nghiệm gần đây tiến bộ trong chẩn đoán giun lươn gồm có một hệ thống ngững kết miễn dịch (luciferase immunoprecipitation system) coh thấy làm tăng độ nhạy và độ đặc hiệu trong phát hiện các kháng thể đặc hiệu trong giun lươn (S. stercoralis-specific antibodies) và kỹ thuật định lượng real-time PCR để phát hiện S. stercoralis trong mẫu phân. Các đặc điểm lâm sàng nặng của nhiễm giun S. stercoralis thấy trên người bị virus T-cell-lymphocytic virus 1 đồng nhiễm trên bệnh nhân có liên quan đến tăng tỷ lệ T cell, điều này có thể chịu trách nhiệm cho đáp ứng tế bào hạt sau khi điều trị. 6. Đánh giá thử nghiệm IFA cho chẩn đoán bệnh giun lươn và ứng dụng theo dõi bệnh Giun lươn là một bệnh mãn tính, giun truyền qua đất và có phân bố khắp thế giới. Ước tính hiện nay khoảng 30-100 triệu người nhiễm trên phạm vi toàn cầu nhưng tỷ lệ nhiễm chính xác là bao nhiêu thì chưa có dữ liệu cụ thể. Mặc dù bệnh giun lươn lưu hành tại nhiều quốc gia nhiệt đới và cận nhiệt đới (cận sa mạc Sahara, châu Phi, châu Mỹ Latinh, Đông Nam Á và bắc Australia), tập trung lưu hành thấp cũng được báo cáo tại các vùng ổn định, như vùng Trung Đông, Đông Âu và dông nam của Mỹ. Do chu kỳ tự nhiễm đặc biệt, Strongyloides stercoralis có thể tồn tại trong vật chủ trong một thời gian dài và không xác định. Hầu hết những người nhiễm không có triệu chứng, có thể xuất hiện triệu chứng đặc hiệu và có các triệu chứng từng đợt và có tăng bạch cầu ái toan tái hồi rất khó giải thích. Tuy nhiên, trong một số trường hợp suy giảm miễn dịch, bệnh giun lượt có thể trở thành một bệnh nhiễm trùng lan tỏa đe dọa tính mạng. Tiếc thay, việc chẩn đoán vẫn là một thử thách. Những lúc mà lưu lượng và mật độ ấu trùng trên những trường hợp nhiễm trùng không biến chứng, độ nhạy của xét nghiệm phân sẽ rất thấp. Ngoài ra, các thuốc ký sinh trùng hiện đang sẵn có không phải luôn luôn loại khỏi bệnh một cách hoàn toàn. Kết quả là nguy cơ thất bại chẩn đoán bệnh cũng là khó khăn cho xác định hiệu quả điều trị. Do đó, phản ứng ELISA và phanru ứng IFA phát hiện kháng thể gián tiếp (IFAT) đã phát triển lên với độ nhạy và độ đặc hiệu rộng hơn. Đánh giá tính chính xác của thử nghiệm huyết thanh chẩn đoán huyết thanh học có giới hạn bởi thiếu đi tiêu chuẩn vàng. Do đó, tính thiết thực của thử nghiệm miễn dịch trong chẩn đoán và theo dõi vẫn còn đang tranh luận. Mục đích của nghiên cứu là đánh giá độ nhạy và độ đặc hiệu của IFAT đối với bệnh giun lươn S. stercoralis ở các ngưỡng nồng độ kháng thể hay hiệu giá kháng thể khác nhau để xác định ngưỡng tối ưu đưa ra quyết định lâm sàng và đưa vào các thử nghiệm lâm sàng. Ngoài ra, để thử tính hữu dụng của huyết thanh học như một công cụ giám sát, thay đổi hiệu giá kháng thể đặc hiệu được đo sau khi điều trị trong một nhóm gồm 155 bệnh nhân qua 4 tháng theo dõi. Công trình nghiên cứu trên do nhóm tác giả Marina Boscolo, Maria Gobbo, William Mantovani, Monica Degani, Mariella Anselmi, Geraldo Badona Monteiro, Stefania Marocco, Andrea Angheben, Manuela Mistretta, Maria Santacatterina, Stefano Tais và Zeno Bisoffi đang công tác tại Trung tâm bệnh nhiệt đới, bệnh viện Sacro Cuore, Negrar, Verona, Ý và Đơn vị nghiên cứu y tế công cộng và y học, đại học Verona, Ý Tính chính xác của chẩn đoán IFAT đối với bệnh giun lươn Strongyloides stercoralis tại các hiệu giá kháng thể huyết thanh khác nhau được đánh giá. Để đánh giá tình nhạy của chẩn đoán, huyết thanh của 156 bệnh nhân nhiễm giun lươn được thu nhận. Huyết thanh âm tính với giun lươn cũng được thu thập từ một nhóm gồm 427 đối tượng (người cho máu và bệnh nhân nhập viện). Với các vùng dưới các dữ liệu vận hành - tiếp nhận là 0.98, phản ứng IFAT cho thấy tính chính xác của chẩn đoán cao cho bệnh giun lươn. Hiệu giá kháng thể 1:20, với độ nhạy 97% và độ đặc hiệu 98% xác định như ngưỡng chẩn đoán tốt nhất cho tất cả mẫu. Phản ứng chéo được đánh giá với 41 mẫu thêm từ các bệnh nhân nhiễm giun sán khác đã biết và phản ứng IFAT đã phát hiện mức hiệu giá dương tính ngưỡng trong 1 đối tượng nhiễm giun chỉ. Kết quả IFAT dương tính ở độ pha loãng kháng thể 1:80 thì đạt độ đặc hiệu 100%, với 71% độ nhạy. Để thử nghiệm tính hữu ích của IFAT như một công cụ giám sát, các thay đổi về hiệu giá kháng thể đặc hiệu sau khi điều trị trong một nhóm 155 bệnh nhân được đánh giá. Sự chuyển đổi huyết thanh hoặc giảm hiệu giá kháng thể 2 lần hoặc hơn được nhìn thấy trong 60% số bệnh nhân. Đáp ứng với điều trị liên quan trực tiếp với hiệu giá kháng thể ban đầu và hiệu giá kháng thể cơ bản 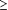 1:80 được xác định là chỉ số tiên đoán tốt nhất về đáp ứng điều trị. 1:80 được xác định là chỉ số tiên đoán tốt nhất về đáp ứng điều trị. Các kết quả nghiên cứu đã chỉ ra một kết quả IFAT dương tính với pha loãng kháng thể 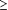 1:20 là ngưỡng tối ưu cho sàng lọc bệnh. Hiệu giá kháng thể 1:20 là ngưỡng tối ưu cho sàng lọc bệnh. Hiệu giá kháng thể 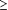 1:80, kết quả không có dương tính giả là ngưỡng đáng tin cậy để đánh giá về mặt huyết thanh học trong hiệu lực điều trị hoặc trong các thử nghiệm lâm sàng. 1:80, kết quả không có dương tính giả là ngưỡng đáng tin cậy để đánh giá về mặt huyết thanh học trong hiệu lực điều trị hoặc trong các thử nghiệm lâm sàng. 7. Dịch tễ học miễn dịch / huyết thanh của bệnh giun lươn tại Peru Nhóm tác giả Pablo p. Yori, Margaret Kosek, Robert H. Gilman, Julianna Cordova, Caryn Bern, Cesar Banda Chavez, Maribel Paredes Olortegui, Carmen Montalvan, Graciela Meza Sanchez, Bevelle Worthen, James Worthen, Fay Leung, Carlos Vidal Oré đang công tác tại khoa sức khỏe quốc tế, đại học Johns Hopkins, Y tế công cộng Baltimore, Maryland; khoa bệnh ký sinh trùng, Trung tâm bệnh truyền nhiễm quốc gia; Trung tâm phòng chống bệnh tật, Atlanta, Georgia và Bộ Y tế Peru đồng tiến hành nghiên cứu. Ước tính hiện nay ít nhất 100 triệu dân nhiễm giun lươn Strongyloides stercoralis trên toàn thế giới. Với tỷ lệ gia tăng nhiễm trùng HIV ở người tại các vùng lưu hành bệnh, tầm uqna trọng của các bệnh giun truyền qua đất lại gia tăng. Toàn bộ chu kỳ của giun lươn S. stercoralis có thể hoàn thành ngay trong đất, dẫn đến các vùng vốn dĩ lưu hành bệnh lại tồn tại bệnh trong một thời gian dài hơn. Tương tự, chu kỳ này cũng có thể hoàn thành trong cơ thể vật chủ theo cách tự nhiễm (autoinfection), điều này dẫn đến tồn tại thể nhiễm chủ động và tăng tốc cũng như phát rộng tình hình nhiễm và cường độ nhiễm lên. Sự bùng phát lượng giun lươn S. stercoralis trong hầu hết các trường hợp nhiễm nặng tương đối hiếm nhưng có thể đe dọa tính mạng bệnh nhân, nhất là các bệnh nhân có hội chứng tăng nhiễm và trên các đối tượng suy giảm miễn dịch (hyperinfection syndrome). Hậu quả của những ca nhiễm nhẹ ít rõ ràng. Tuy nhiên, một nghiên cứu gần đây ở Tanzania xác định nhiễm S. stercoralis trên các phụ nữ nhiễm HIV như một yếu tố nguy cơ nặng để cho ra các đứa trẻ cân nặng thấp lúc sinh và điều đó tương đối phổ biến dẫn đến tiêu chảy trên những bệnh nhân nhiễm HIV và trẻ em suy dinh dưỡng. Cho dù tỷ lệ nhiễm cao, kiến thức về dịch tễ học và dịch tễ học huyết thanh (seroepidemiology) vẫn còn biết hạn chế. Nhóm nghiên cứu đã tiến hành một điều tra trên một nhóm dân làng quanh đô thị của Peruvian Amazon với các xét nghiệm phân và huyết thanh cho bệnh giun lươn S. stercoralis. Mục đích là so sánh biện pháp sàng lọc phan và xét nghiệm huyết thanh học như thế nào, đánh giá mức độ dương tính chéo với các loại giun sán khác trong đất và đặc điểm của dịch tễ học tại cộng đồng của ký sinh trùng. Một xét nghiệm phân và điều tra về mặt huyết thanh học cho bệnh giun lươn S.stercoralis được tiến hành tại một cộng đồng vùng Peruvian Amazon. S.stercoralis được xác định trong phân của 69 (8.7%) trong tổng số 792 đối tượng tham gia nghiên cứu. 609 mẫu huyết thanh được thử bằng ELISA cho độ nhạy 92% và độ đặc hiệu 94%; 442 (72%) dương tính. Trong mô hình hình phân tích hồi quy tuyến tuyến đa biến. S. stercoralis trong phân có liên quan đến giun móc trong cùng mẫu phân (OR = 4.44, 95%; CI = 2.02–9.79), bệnh nhân thỉnh thoảng hoặc chưa bao giờ mang giày (OR = 1.89, 95% CI = 1.10–3.27), và tăng theo tuổi (OR = 1.012 đối với tuổi tăng lên 1, 95% CI = 1.00–1.03). Tương tự, các bệnh nhân thỉnh thoảng hoặc không bao giờ mang giày (OR = 1.54, 95% CI = 1.01–2.37) và tăng theo tuổi (OR = 1.04 đối với nhóm tăng lên theo 1 tuổi, 95% CI = 1.02–1.06) có liên quan đến tăng nguy cơ kết quả dương tínhS. stercoralis ELISA. Thử nghiệm ELISA có giá trị dự kiến âm tính đến 98% và đây được xem là một thử nghiệm sàng lọc tốt coh bệnh giun lương. 8. Dị ứng, ký sinh trùng và vấn đề giả thuyết vệ sinh - quan tâm hiện nay Nhóm tác giả Maria Yazdanbakhsh, Peter G. Kremsner, Ronald van Ree đang làm việc tại khoa ký sinh trùng, đại học Leiden, Hà Lan; Khoa ký sinh trùng, viện y học nhiệt đới, đại học Tuebingen, Đức; Đơn vị nghiên cứu bệnh viện Albert Schweitzer, Lambarene, Gabon. Khoa miễn dịch bệnh lý, Trung tâm nghiên cứu Sanquin tại CLB, Amsterdam, Hà Lan cùng nghiên cứu cho biết tỷ lệ bệnh dị ứng tại các quốc gia công nghiệp đã được ghi nhận và làm rõ nhờ vào giảm đi nhiễm trùng cho trẻ. Các giải thích về miễn dịch liên quan đến phần phụ T cell chức năng được biết là T helper 1 (TH1) và T helper 2 (TH2). Bệnh cũng được cảnh báo do nhiễm vi khuẩn và virus trong suốt giai đoạn đầu của cuộc đời đến khi trưởng thành hệ thống miễn dịch hướng về TH1, trong đó có đáp ứng tiền di ứng không cân bằng của các tế bào TH2. Do vậy, một sự giảm toàn bọ gánh nặng vi trùng sẽ dẫn đến làm yếu đi TH1 cho phép tăng dị ứng. Sự lưu ý này bị chỉ trích do quan sát các tỷ lệ bệnh tự miễn TH1 cũng tăng và ký sinh trùng liên quan đến TH2 không có mối liên quan với dị ứng. Gần đây hơn, tăng các cytokine chống viêm, như interleukin-10, xảy ra trong quá trình nhiễm giun lâu dài cho thấy liên quan đảo nghịch với dị úng. Tài liệu tham khảo 1.Arakaki, T., M. Iwanaga, F. Kinjo, A. Saito, R. Asato, and T. Ikeshiro. 1990. Efficacy of agar-plate culture in detection of Strongyloides stercoralis infection. J. Parasitol. 76:425-428.[CrossRef][Medline] 2.Badaro, R., E. M. Carvalho, R. B. Santos, A. A. Gam, and R. M. Genta. 1987. Parasite-specific humoral responses in different clinical forms of strongyloidiasis. Trans. R. Soc. Trop. Med. Hyg. 81:149-150.[CrossRef][Medline] 3.Carroll, S. M., K. T. Karthigasu, and D. I. Grove. 1981. Serodiagnosis of human strongyloidiasis by an enzyme-linked immunosorbent assay. Trans. R. Soc. Trop. Med. Hyg. 75:706-709.[CrossRef][Medline] 4.Conway, D. J., N. S. Atkins, J. E. Lillywhite, J. W. Bailey, R. D. Robinson, J. F. Lindo, D. A. Bundy, and A. E. Bianco. 1993. Immunodiagnosis of Strongyloides stercoralis infection: a method for increasing the specificity of the indirect ELISA. Trans. R. Soc. Trop. Med. Hyg. 87:173-176.[CrossRef][Medline] 5.Conway, D. J., J. W. Bailey, J. F. Lindo, R. D. Robinson, D. A. Bundy, and A. E. Bianco. 1993. Serum IgG reactivity with 41-, 31-, and 28-kDa larval proteins of Strongyloides stercoralis in individuals with strongyloidiasis. J. Infect. Dis. 168:784-787.[Medline] 6.Elkins, D. B., M. R. Haswell-Elkins, E. Mairiang, P. Mairiang, P. Sithithaworn, S. Kaewkes, V. Bhudhisawasdi, and T. Uttaravichien. 1990. A high frequency of hepatobiliary disease and suspected cholangiocarcinoma associated with heavy Opisthorchis viverrini infection in a small community in north-east Thailand. Trans. R. Soc. Trop. Med. Hyg. 84:715-719.[CrossRef][Medline] 7.Escobar-Gutierrez, A., M. E. Amezcua, S. Pasten, F. Pallares, J. V. Cazares, R. M. Pulido, O. Flores, E. Castro, and O. Rodriguez. 1993. Comparative assessment of the leprosy antibody absorption test, Mycobacterium leprae extract enzyme-linked immunosorbent assay, and gelatin particle agglutination test for serodiagnosis of lepromatous leprosy. J. Clin. Microbiol. 31:1329-1333.[Abstract/Free Full Text] 8.Gam, A. A., F. A. Neva, and W. A. Krotoski. 1987. Comparative sensitivity and specificity of ELISA and IHA for serodiagnosis of strongyloidiasis with larval antigens. Am. J. Trop. Med. Hyg. 37:157-161. 9.Genta, R. M. 1989. Global prevalence of strongyloidiasis: critical review with epidemiologic insights into the prevention of disseminated disease. Rev. Infect. Dis. 11:755-767.[Medline] 10.Genta, R. M. 1988. Predictive value of an enzyme-linked immunosorbent assay (ELISA) for the serodiagnosis of strongyloidiasis. Am. J. Clin. Pathol. 89:391-394.[Medline] 11.Harada, Y., and O. Mori. 1955. A new method for culturing hookworm. Yagano Acta Med. 1:177-179. 12.Izumi, S., T. Fujiwara, M. Ikeda, Y. Nishimura, K. Sugiyama, and K. Kawatsu. 1990. Novel gelatin particle agglutination test for serodiagnosis of leprosy in the field. J. Clin. Microbiol. 28:525-529.[Abstract/Free Full Text] 13.Jongsuksuntigul, P., P. M. Intapan, T. Wongsaroj, S. Nilpan, S. Singthong, S. Veerakul, and W. Maleewong. 2003. Prevalence of Strongyloides stercoralis infection in northeastern Thailand (agar plate culture detection). J. Med. Assoc. Thai. 86:737-741.[Medline] 14.Kobayashi, J., Y. Sato, H. Toma, M. Takara, and Y. Shiroma. 1994. Application of enzyme immunoassay for postchemotherapy evaluation of human strongyloidiasis. Diagn. Microbiol. Infect. Dis. 18:19-23.[CrossRef][Medline] 15.Koga, K., S. Kasuya, C. Khamboonruang, K. Sukhavat, M. Ieda, N. Takatsuka, K. Kita, and H. Ohtomo. 1991. A modified agar plate method for detection of Strongyloides stercoralis. Am. J. Trop. Med. Hyg. 45:518-521. 16.Lindo, J. F., N. S. Atkins, M. G. Lee, R. D. Robinson, and D. A. Bundy. 1996. Parasite-specific serum IgG following successful treatment of endemic strongyloidiasis using ivermectin. Trans. R. Soc. Trop. Med. Hyg. 90:702-703.[CrossRef][Medline] 17.Lindo, J. F., D. J. Conway, N. S. Atkins, A. E. Bianco, R. D. Robinson, and D. A. Bundy. 1994. Prospective evaluation of enzyme-linked immunosorbent assay and immunoblot methods for the diagnosis of endemic Strongyloides stercoralis infection. Am. J. Trop. Med. Hyg. 51:175-179. 18.Lowry, O. H., N. J. Rosebrough, A. L. Farr, and R. J. Randall. 1951. Protein measurement with the Folin phenol reagent. J. Biol. Chem. 193:265-275.[Free Full Text] 19.Mangali, A., W. Chaicumpa, P. Nontasut, P. Chantavanij, P. Tapchaisri, and C. Viravan.1991. Enzyme-linked immunosorbent assay for diagnosis of human strongyloidiasis. Southeast Asian J. Trop. Med. Public Health 22:88-92. 20.Neva, F. A. 1986. Biology and immunology of human strongyloidiasis. J. Infect. Dis. 153:397-406.[Medline] 21.Neva, F. A., A. A. Gam, and J. Burke. 1981. Comparison of larval antigens in an enzyme-linked immunosorbent assay for strongyloidiasis in humans. J. Infect. Dis. 144:427-432.[Medline] 22.Neva, F. A., A. A. Gam, C. Maxwell, and L. L. Pelletier. 2001. Skin test antigens for immediate hypersensitivity prepared from infective larvae of Strongyloides stercoralis. Am. J. Trop. Med. Hyg. 65:567-572.[Abstract] 23.Sato, Y., J. Kobayashi, H. Toma, and Y. Shiroma. 1995. Efficacy of stool examination for detection of Strongyloides infection. Am. J. Trop. Med. Hyg. 53:248-250. 24.Sato, Y., M. Takara, and M. Otsuru. 1985. Detection of antibodies in strongyloidiasis by enzyme-linked immunosorbent assay (ELISA). Trans. R. Soc. Trop. Med. Hyg. 79:51-55.[CrossRef][Medline] 25.Sato, Y., H. Toma, S. Kiyuna, and Y. Shiroma. 1991. Gelatin particle indirect agglutination test for mass examination for strongyloidiasis. Trans. R. Soc. Trop. Med. Hyg. 85:515-518.[CrossRef][Medline] 26.Satoh, M., H. Toma, Y. Sato, M. Kikuchi, M. Takara, Y. Shiroma, S. Kiyuna, and K. Hirayama. 1999. Production of a high level of specific IgG4 antibody associated with resistance to albendazole treatment in HLA-DRB1*0901-positive patients with strongyloidiasis. Am. J. Trop. Med. Hyg. 61:668-671.[Abstract] 27.Siddiqui, A. A., C. S. Stanley, and S. L. Berk. 2000. Cloning and expression of isocitrate lyase from human round worm Strongyloides stercoralis. Parasite 7:233-236.[Medline] 28.Sithithaworn, P., T. Srisawangwong, S. Tesana, W. Daenseekaew, J. Sithithaworn, Y. Fujimaki, and K. Ando. 2003. Epidemiology of Strongyloides stercoralis in north-east Thailand: application of the agar plate culture technique compared with the enzyme-linked immunosorbent assay. Trans. R. Soc. Trop. Med. Hyg. 97:398-402.[CrossRef][Medline] 29.Uparanukraw, P., S. Phongsri, and N. Morakote. 1999. Fluctuations of larval excretion in Strongyloides stercoralis infection. Am. J. Trop. Med. Hyg. 60:967-973.[Abstract] 30.Yoshida, T., T. Matsui, S. Kobayashi, and N. Yamamoto. 1987. Evaluation of passive particle agglutination test for antibody to human immunodeficiency virus. J. Clin. Microbiol. 25:1433-1437.[Abstract/Free Full Text]
|

