 |
| P. vivax (nguồn ảnh: http://atlas.or.kr) |
Chiến lược kiểm soát và loại trừ sốt rét do Plasmodium vivax toàn cầu (Phần 2)
Sự thay đổi và chuyển dịch cơ cấu giữa hai loài ký sinh trùng sốt rét Plasmodium falciparum và Plasmodium vivax khiến cho các nhà làm chính sách thay đổi và điều chỉnh nhiều mục và chú ý hơn trong vấn đề điều trị tiệt căn ca bệnh (dự trù tăng lượng thuốc primaquine và chloroquine, theo dõi và quản lý ca bệnh sốt rét sẽ dài ngày hơn đối với sốt rét do P. vivax). Trước đây, phần lớn số ca mắc sốt rét do P. vivax tại Việt Nam chủ yếu gặp ở khu vực các tỉnh phía bắc, song nay hầu hết các tỉnh trong khu vực miền Trung-Tây Nguyên, cơ cấu 50-50% đang tiến dần đối với P. falciparum - P. vivax, điều này tương tự như trên sẽ gây khó khăn trong phòng chống và quản lý ca bệnh cũng như thay đổi chiến lược trong tiến tới lộ trình loại trừ sốt rét do P. vivax trên phạm vi toàn cầu cũng như tại Việt Nam trong thời gian đến do đặc điểm khác biệt với P. falciparum trong chu kỳ sinh học, nên khâu quản lý liệu một bệnh nhân có tuân thủ việc uống thuốc điều trị tiệt căn trong vòng 14 ngày của liệu trình primaquine đầy đủ không? Hơn nữa, P. vivax không phải là cái bóng của P. falciparum mà phạm vi phân bố của chúng rất rộng trên nhiều khu vực trên toàn cầu. 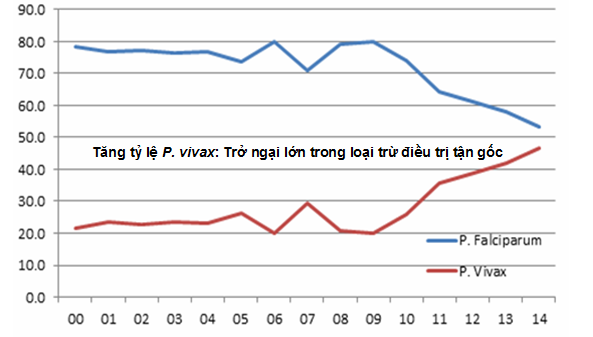
Điều trị sốt rét thường do loài P. vivax Về mặt kinh điển, phác đồ điều trị sốt rét do P. vivax tại hầu hết các quốc gia không thay đổi về liệu trình và liều lượng thuốc không thay đổi mà chỉ duy trì liệu trình 3 ngày, tổng liều 25mg. Với liệu trình này cho thấy P. vivax vẫn còn nhạy cảm với thuốc chloroquine, với tỷ lệ đáp ứng lâm sàng và điều trị (ACPR) cũng như hiệu quả đạt được trên 95% và tỷ lệ còn tồn tại ký sinh trùng thể vô tính của P. vivax ngày D3 (sau 72 giờ) kể từ khi điều trị không đáng kể. Bảng 1: Thuốc sốt rét theo nhóm người bệnh và chủng loạiký sinh trùng sốt rét Nhóm tuổi/ người bệnh | Sốt rét lâm sàng | Sốt rét do P.falciparum | Sốt rét do P.vivax/ P.ovale | Sốt rét do P.malariae/ P.knowlesi | Sốt rét nhiễm phối hợp có P.falciparum | Dưới 3 tuổi | DHA-PPQ(1) | DHA- PPQ(1) | Chloroquin | Chloroquin | DHA-PPQ(1) | Từ 3 tuổi trở lên | DHA-PPQ(1) | DHA-PPQ(1) + Primaquin | Chloroquin + Primaquin | Chloroquin + primaquin | DHA-PPQ(1) +Primaquin | Phụ nữcó thai trong 3 tháng | Quinin + Clindamycin ) | Quinin + Clindamycin | Chloroquin | Chloroquin | Quinin + Clindamycin | Phụ nữ có thai trên 3 tháng | DHA-PPQ (1) | DHA-PPQ (1) | Chloroquin | Chloroquin | DHA-PPQ (1) |
(1)DHA (Dihydroartemisinin)-PPQ(piperaquin phosphat) vói biệt dược là CV Artecan, Arterakine. - Liều tính theo cân nặng: Tổng liều 25mg bazơ/kg, chia 3 ngày điều trị như sau: + Ngày 1: 10 mg base/kg cân nặng. + Ngày 2: 10 mg base/kg cân nặng. + Ngày 3:5 mg base/kg cân nặng. - Liều tính theo nhóm tuổi (nếu không có cân) như sau: Bảng 2: Bảng tính liều chloroquin theo nhóm tuổi và cân nặng Nhóm tuổi | Ngày 1 (viên) | Ngày 2 (viên) | Ngày 3 (viên) | Dưới 1 tuổi | 1/2 | ½ | 1/4 | ≥ 1 - < 5 tuổi | 1 | 1 | 0,5 | ≥ 5 - < 12 tuổi | 2 | 2 | 1 | ≥ 12 - < 15 tuổi | 3 | 3 | 1,5 | ≥ 15 tuổi | 4 | 4 | 2 |
Ngoại trừ một số quốc gia hay vùng lãnh thổ có tình trạng kháng thuốc chloroquine do P. vivax đã thay đổi chiến lược và danh mục thuốc thiết yếu sốt rét trong điều trị sốt rét do P. vivax này, thay chloroquine bằng phác đồ các thuốc phối hợp có thành phần artemisinin (ACTs). Phác đồ thường kết hợp giữa chloroquine với primaquine (nếu không có chống chỉ định nhóm thuốc này) theo liệu trình 14 ngày liên tiếp. Song sự tuân thủ điều trị với phác đồ primaquine, đặc biệt vào các ngày khi bệnh nhân xuất viện và được cấp thuốc về nhà điều trị tiếp liệu có tuân thủ đầy đủ hay không vẫn còn là vấn đề nên quan tâm. Điều trị sốt rét nặng hoặc sốt rét ác tính do P. vivax Nguyên tắc Mối liên hệ giữa bệnh nặng với mức độ số lượng ký sinh trùng rất thấp đã được thấy ở P. vivax. Mật độ ký sinh trùng tương đối thấp thì rất khó phát hiện nhiễm loài này, trái ngược với P. falciparum. Trong một nghiên cứu tại một bệnh viện Brazil, các tiêu chí đối với sốt rét do P. falciparum nặng/ SRAT có tương quan chặt chẽ với chẩn đoán do P. vivax và đưa vào khoa chăm sóc tích cực (intensive care unit _ICU), mặc dù mật độ ký sinh trùng liên quan đến việc đưa vào khoa ICU là tương đối thấp (500 ký sinh trùng/ml máu). Các biểu hiện bệnh sốt rét do P. vivax nặng bao gồm thiếu máu, giảm tiểu cầu, phù phổi cấp tính và các biểu hiện ít phổ biến như sốt rét ác tính thể não, thiếu máu bất sản, vàng da, vỡ lách, triệu chứng tiểu hemoglobin, suy thận cấp và sốc. Các thử nghiệm đa trung tâm quy mô lớn ở những bệnh nhân châu Á và châu Phi đã được chứng minh rõ ràng sau tiêm artesunate trong tĩnh mạch tốt hơn so với quinine trong việc giảm tỷ lệ tử vong ca (Case fatality rates_CFRs) ở các trường hợp sốt rét do P. falciparum nặng. Artesunate đường tĩnh mạch cũng dẫn đến phản ứng lâm sàng nhanh chóng ở những bệnh nhân sốt rét nặng do P. vivax. Thách thức Hiện vẫn chưa có các thử nghiệm lâm sàng so sánh tỷ lệ tử vong ca trên các nhóm bệnh nhân dùng artesunate tĩnh mạch so với quinine tiêm đối với các BNSR nhiễm P. vivax nặng. Đề nghị -Sốt rét nặng do loài P. vivax được định nghĩa như sốt rét nặng do P. falciparum nhưng không có ngưỡng mật độ ký sinh trùng; -Các phương pháp điều trị sốt rét được khuyến cáo cho bệnh sốt rét nặng do P. vivax đều giống như đối với bệnh sốt rét do P. falciparum. Người lớn và trẻ em bị sốt rét nặng (kể cả trẻ sơ sinh, phụ nữ mang thai ở tất cả các giai đoạn của thai kỳ và phụ nữ cho con bú) nên được điều trị bằng artesunate tiêm tĩnh mạch hoặc tiêm bắp trong ít nhất 24 giờ và cho đến khi họ có thể uống được thuốc. Trẻ cân nặng dưới 20kg nên nhận một liều artesunate cao hơn (3mg/kg cân nặng/liều) so với trẻ lớn hơn và người lớn (2,4 mg/kg/liều). Nếu artesunate tiêm này không có thì artemether nên được sử dụng tốt hơn quinine. Tiếp theo artesunate đường tiêm cho ít nhất 24 giờ, điều trị có thể được hoàn thành với một liều trình điều trị đầy đủ thuốc phối hợp ACTs đường uống hoặc chloroquine (ở những quốc gia chloroquine được lựa chọn điều trị ưu tiên). Một liệu trình điều trị triệt căn với thuốc primaquine nên được đưa ra sau khi hồi phục (59). 
Kháng thuốc và quản lý ca bệnh kháng thuốc Nguyên tắc Các phương pháp và kỹ thuật khác nhau đã được sử dụng để đánh giá hiệu quả/ hiệu lực của thuốc sốt rét đối với P. falciparum: những nghiên cứu về hiệu quả/ hiệu lực điều trị (nghiên cứu đánh giá hiệu lực thuốc (Theurapeutic efficacy study_TES hoặc in vivo), các thử nghiệm in vitro và sử dụng các chỉ điểm phân tử liên quan đến kháng thuốc. Tuy nhiên, hiện nay chỉ có các TES là phương pháp thích hợp và ư thế cho các chương trình kiểm soát để sử dụng giám sát kháng thuốc ở P. vivax. Để giải thích và so sánh các kết quả trong khu vực và giữa các khu vực và theo xu hướng thời gian, giám sát hiệu quả điều trị phải tuân theo các bước quy chuẩn của đề cương từ TCYTTG. -Xác định sự có mặt P. vivax kháng chloroquin, điều này là rất cần thiết không chỉ kiểm tra tái phát nhiễm trong thời gian ít nhất 28 ngày, mà còn đo nồng độ chloroquin và chất chuyển hóa desethylchloroquine trong máu vào lúc tái phát xuất hiện lại ký sinh trùng. Trong trường hợp chloroquin, kháng có thể được xác định bằng cách đo nồng độ máu toàn phần vào lúc tái phát. Bất cứ trường hợp nhiễm P. vivax đã phát triển kháng in vitro thông qua nồng độ máu toàn phần chloroquine và chất chuyển hóa DCQ >100 ng/ml được xem là kháng chloroquin. Tuy nhiên, các nồng độ máu thích hợp cho các loại thuốc chống sốt rét khác cần phải được cải thiện; -Kháng chloroquin lần đầu tiên được báo cáo vào năm 1989 ở Úc từ các du khachs trở về từ Papua New Guinea. Thất bại điều trị vào hoặc trước ngày thứ 28 hoặc thất bại dự phòng (prophylactic failure) với chloroquin đã được nhìn thấy ở 21 quốc gia. Tuy nhiên, việc đo nồng độ chloroquin trong máu không được thực hiện ở tất cả các nghiên cứu. Ít nhất một ca kháng chloroquin chính xác (với các nồng độ máu toàn phần của chloroquin cộng với desethylchloroquine 100 ng/ml song hành vào ngày thất bại) đã được báo cáo ở 9 quốc gia gồm Brazil, Ethiopia, Indonesia, Malaysia, Myanmar, Papua New Guinea, Peru, Solomon Islands và Thái Lan; -Thất bại điều trị theo sau liệu trình điều trị với primaquine đã được báo cáo ở một số chủng P. vivax, đặc biệt từ khu vực Tây Thái Bình Dương, Đông Nam Á, Nam Mỹ và một số vùng ở châu Phi. Tuy nhiên, các dữ liệu này không thể đưa đến kết luận kháng primaquin vì có một vài yếu tố nhiễu. Chẳng hạn như khác nhau về vị trí địa lý trong các mô hình tái phát, điều trị không có giám sát, nguy cơ tái nhiễm và khó khăn trong việc phát hiện nhóm kiểm soát hợp lý. Điều đó cũng có thể là cần thiết để loại trừ chuyển hóa chậm kiểu hình cytochrome P450 2D6 để xác định kháng. 
Thách thức -Một khó khăn lớn trong việc giải thích kết quả các TES cho P. vivax là không có khả năng để phân biệt chính xác giữa tái phát (relapse) và tái phát sớm (recrudescence) và tái nhiễm (re-infection/ new infection). Các chỉ điểm phân tử cho kiểu gen P. vivax ít có ích trong TES so với ở nghiên cứu TES do P. falciparum vì tái phát có thể được gây ra bởi kiểu gen giống nhau gây bệnh ban đầu hoặc một kiểu gen khác. Tái phát là không chắc chắn xảy ra nếu số lượng ký sinh trùng tái diễn trong vòng 16 ngày kể từ ngày điều trị nhưng sau thời gian đó, tái phát không thể được phân biệt giữa tái phát sớm hoặc tái nhiễm. Điều này có thể đặc biệt quan trọng ở ACTs với thời gian bán hủy ngắn, chẳng hạn như thuốc phối hợp artemether-lumefantrine; -Vấn đề nuôi cấy thành công và áp dụng các thử nghiệm nhạy cảm đối với P. vivax hiện vẫn còn nhiều thách thức và khó khăn. Ngoài ra, không có tiêu chuẩn trong phương pháp invitro đối với P. vivax. Mặt dù trong thời gian ngắn in vitro nuôi cấy thực địa cho phép phân lập đánh giá độ nhạy P. falciparum với thuốc diệt thể phân liệt mô/ tư dưỡng, nó hiếm khi được thực hiện bên ngoài các phòng thí nghiệm nghiên cứu chuyên ngành. Phát triển các thử nghiệm in vitro tương tự cho P. vivax đang là thách thức bởi vì ký sinh trùng ưu thế xâm nhập vào các tế bào hồng cầu non (khác với P. falciparum là xâm nhập vào tất cả các giai đoạn hồng cầu), hạn chế khả năng sinh sản và khả năng thích ứng liên tục trong nuôi cấy in vitro. Hơn nữa, chloroquin ưu tiên giết giai đoạn thể tư dưỡng non của P. vivax hơn so với thể tư dưỡng trưởng thành và nhiễm P. vivax thể hiện các tỷ lệ của các nhóm dân số thay đổi, vì vậy các trường hợp nhiễm nhạy với chloroquin chi phối bởi các hình thức trưởng thành sẽ xuất hiện kháng cao. Do vậy, sự phát triển ký sinh trùng phải được kiểm soát bằng thực nghiệm; -Hiện chưa có các chỉ điểm phân tử đã được xác định đối với kháng chloroquin; -Giám sát hiệu lực thuốc primaquin yêu cầu điều trị với thuốc diệt thể phân liệt mô (schizonticidal drugs) với thời gian bản hủy ngắn ở môi trường nơi không có (hoặc ít) nguy cơ tái nhiễm và theo dõi bệnh nhân đáp ứng với các đặc điểm của ký sinh trùng (đôi khi lên đến 1 năm). Các kết quả phải được so sánh với tỷ lệ tái phát được biết ở khu vực, hoặc với các kết quả ở nhóm đối chứng mà primaquin cấm chỉ định; -Ngoài ra, sự tương tác giữa hệ thống cytochrome P450 polymorphism (CYP2D6) và chuyển hóa primaquin có thể làm giảm hiệu quả rõ rệt của thuốc primaquin bằng cách giảm sinh khả dụng ở những bệnh nhân với điều kiện. Hiện nay nó không thể kiểm tra rộng rãi cho điều kiện nay, và do đó nó rất khó để theo dõi hiệu quả primaquine trong một cách tiêu chuẩn. 
Đề nghị Tổ chức Y tế thế giới (TCYTTG) đã đưa ra các khuyến cáo trong việc giám sát và quản lý kháng thuốc sốt rét trong các phương pháp giám sát hiệu quả thuốc chống sốt rét: -Các chương tình kiểm soát sốt rét quốc gia nên thiết lập những điểm sentinel để giám sát hiệu quả của thuốc sốt rét. Kinh nghiệm cho thấy rằng, 4 đến 8 điểm trên mỗi quốc gia sẽ là mục tiêu cân bằng giữa tính đại diện và thực tiễn. Các điểm giám sát trọng điểm nên đại diện cho tất cả các vùng dịch tễ ở quốc gia, nhưng nó là cần thiết để chọn lựa “quản lý” số điểm để đảm bảo theo dõi và giám sát thích hợp. Nếu khả thi, các Chương trình kiểm soát sốt rét quốc gia nên sử dụng những điểm giống nhau để giám sát để giám sát hiệu quả thuốc sốt rét chống lại cả P. falciparum và P. vivax; -Đề nghị chỉ được theo dõi đến 28 ngày bởi vì không có các chỉ điểm phân tử được xác định sự khác nhau giữa tái nhiễm (reinfection), tái phát (relapse) và tái phát sau điều trị (recrudescence). Kể từ khi thuốc phối hợp ACTs đang gia tăng sử dụng để điều trị nhiễm P. vivax, đặc biệt trong tình hình nơi mà kháng chloroquin, độ nhạy của P. vivax với các thuốc phối hợp ACTs cũng nên thường xuyên được theo dõi hiệu lực; -Nhiễm P. vivax có một giai đoạn thể ngủ trong gan (dormant liver stage) và do vậy có khả năng tái phát xa, nhiều quốc gia khuyến cáo liệu pháp primaquin cho điều trị tiệt căn. Dùng đồng thời primaquin hoặc ngay sau khi dùng chloroquin có thể che giấu kháng chloroquin, bởi vì hiệu quả tổng hợp chống lại các ký sinh trùng kháng chloroquin dẫn đến đánh giá thấp nguy cơ điều trị thất bại hoặc kháng chloroquin. Quyết định thêm primaquine với chloroquine hoặc ACTs trong thời gian thử nghiệm đánh giá hiệu lực thuốc sốt rét (TES) sẽ xác định bởi mục tiêu nghiên cứu; đó là, cho dù mục tiêu đánh giá hiệu quả của thuốc thế hệ thứ nhất (bao gồm hiệu quả chống lại tái phát sớm) hoặc hiệu quả của một giai đoạn máu. Trong trường hợp sau, điều trị primaquin nên được đáp ứng cho tới sau 28 ngày theo dõi. Tuy nhiên, nếu chính sách y tế địa phương bao gồm việc sử dụng bắt buộc primaquin với chloroquin/ ACTs, tỷ lệ thất bại điều trị nên đượcxem xét trong việc sử dụng phối hợp primaquine với chloroquin/ ACTs; -Các quốc gia nên xem xét thay đổi điều trị sốt rét với thuốc thế hệ thứ nhất nếu tổng tỷ lệ thất bại điều trị (được định nghĩa là tổng số bệnh nhân thất bại điều trị sớm, thất bại lâm sàng muộn hoặc thất bại ký sinh trùng muộn cao hơn 10%. Việc lựa chọn điều trị sốt rét với thuốc mới để sử dụng tại mức độ y tế cộng đồng trong bối cảnh các hướng dẫn điều trị quốc gia nên dựa vào tỷ lệ điều trị khỏi bệnh trung bình ≥ 95% theo đánh giá trong các thử nghiệm lâm sàng.  vvvvvvvvv vvvvvvvvv
Tài liệu tham khảo 1.Gething PW, Elyazar IR, Moyes CL, Smith DL, Battle KE, Guerra CA et al. A long neglected world malaria map: Plasmodium vivaxendemicity in 2010. PLoS Negl Trop Dis. 2012;6(9):e1814. 2.Battle KE, Gething PW, Elyazar IR, Moyes CL, Sinka ME, Howes RE et al. The global public health signicance of Plasmodium vivax. Advances in Parasitology. 2012;80:1-111. 3.Hay SI, Sinka ME, Okara RM, Kabaria CW, Mbithi PM, Tago CC et al. Developing global maps of the dominant Anophelesvectors of human malaria. PLoS Medicine. 2010;7(2):e1000209. 4.Gething PW, Van Boeckel TP, Smith DL, Guerra CA, Patil AP, Snow RW et al. Modelling the global constraints of temperature on transmission of Plasmodium falciparum and P. vivax. Parasites & Vectors. 2011;4(1):92. 5.Guerra CA, Howes RE, Patil AP, Gething PW, Van Boeckel TP, Temperley WH et al. The international limits and population at risk of Plasmodium vivax transmission in 2009. PLoS Neglected Tropical Diseases. 2010;4(8):e774. 6.Gething PW, Patil AP, Smith DL, Guerra CA, Elyazar IR, Johnston GL et al. A new world malaria map: Plasmodium falciparum endemicity in 2010. Malaria Journal. 2011;10(1):378. 7.Battle KE, Cameron E, Guerra CA, Golding N, Duda KA, Howes RE et al. Dening the relationship between Plasmodium vivaxparasite rate and clinical disease. Malaria Journal. 2015;14(1):191 8.Okell LC, Bousema T, Grin JT, Ouedraogo AL, Ghani AC, Drakeley CJ. Factors determining the occurrence of submicroscopic malaria infections and their relevance for control. Nature Communications. 2012;3:1237. 9.WHO. World malaria report 2014. Geneva, World Health Organization (WHO). 2014 (http://www.who.int/malaria/publications/world_malaria_report_2014). 10.Mendis K, Sina BJ, Marchesini P, Carter R. The neglected burden of Plasmodium vivaxmalaria. Am J Trop Med Hyg. 2001;64(1-2 Suppl):97-106. 11.Je‑ery GM. Epidemiological signicance of repeated infections with homologous and heterologous strains and species of Plasmodium. Bulletin of the World Health Organization. 1966;35(6):873–882. 12.Mueller I, Galinski MR, Baird JK, Carlton JM, Kochar DK, Alonso PL et al. Key gaps in the knowledge of Plasmodium vivax, a neglected human malaria parasite. The Lancet Infectious Diseases. 2009;9(9):555–566. 13.Awab GR, Pukrittayakamee S, Imwong M, Dondorp AM, Woodrow CJ, Lee SJ et al. Dihydroartemisinin-piperaquine versus chloroquine to treat vivax malaria in Afghanistan: an open randomized, non-inferiority, trial. Malaria Journal. 2010;9(1):105. 14.Ratcli‑ A, Siswantoro H, Kenangalem E, Maristela R, Wuwung RM, Laihad F et al. Two xed-dose artemisinin combinations for drug-resistant falciparum and vivax malaria in Papua, Indonesia: an open-label randomised comparison. Lancet. 2007;369(9563):757-765. 15.Garnham PCC. Malaria parasites of man: life-cycles and morphology (excluding ultrastructure). In: Wernsdorfer WH & McGregor I, eds. lMalaria parasites of man: life-cycles and morphology (excluding ultrastructure). Edinburgh, Churchill Livingstone. 1988:61-96. 16.Beutler E. The hemolytic e‑ect of primaquine and related compounds: A review. Blood. 1959;14(2): 103-139. 17.White NJ, Imwong M. Relapse. Advances in Parasitology. 2012;80:113-150. 18.Sutanto I, Tjahjono B, Basri H, Taylor WR, Putri FA, Meilia RA et al. Randomized, open-label trial of primaquine against vivax malaria relapse in Indonesia. Antimicrobial Agents and Chemotherapy. 2013;57(3):1128-1135. 19.White NJ. Determinants of relapse periodicity in Plasmodium vivax malaria. Malaria Journal. 2011;10(1):297. 20.Shanks GD, White NJ. The activation of vivax malaria hypnozoites by infectious diseases. The Lancet Infectious Diseases. 2013;13(10):900-906. 21.Douglas NM, Nosten F, Ashley EA, Phaiphun L, van Vugt M, Singhasivanon P et al. Plasmodium vivaxrecurrence following falciparum and mixed species malaria: Risk factors and effect of antimalarial kinetics. Clin Infect Dis. 2011;52(5):612–620. 22.Looareesuwan S, White NJ, Chittamas S, Bunnag D, Harinasuta T. High rate of Plasmodium vivax relapse following treatment of falciparum malaria in Thailand. Lancet. 1987;2(8567):1052-1055. 23.Betuela I, Rosanas-Urgell A, Kiniboro B, Stanisic DI, Samol L, de Lazzari E et al. Relapses contribute signicantly to the risk of Plasmodium vivaxinfection and disease in Papua New Guinean children 1-5 years of age. The Journal of Infectious Diseases. 2012;206(11):1771-1780. 24.Battle KE, Karhunen MS, Bhatt S, Gething PW, Howes RE, Golding N et al. Geographical variation in Plasmodium vivax relapse. Malaria Journal. 2014;13(1):144. 25.Howes RE, Dewi M, Piel FB, Monteiro WM, Battle KE, Messina JP et al. Spatial distribution of G6PD deciency variants across malaria-endemic regions. Malaria Journal. 2013;12(1):418. 26.Anstey NM, Douglas NM, Poespoprodjo JR, Price RN. Plasmodium vivax: Clinical spectrum, risk factors and pathogenesis. Advances in Parasitology. 2012;80:151-201. 27.Douglas NM, Anstey NM, Angus BJ, Nosten F, Price RN. Artemisinin combination therapy for vivax malaria. The Lancet Infectious Diseases. 2010;10(6):405-416. 28.Baird JK. Evidence and implications of mortality associated with acute Plasmodium vivax malaria. Clinical Microbiology Reviews. 2013;26(1):36-57 29.Douglas NM, Pontororing GJ, Lampah DA, Yeo TW, Kenangalem E, Poespoprodjo JR et al. Mortality attributable to Plasmodium vivax malaria: A clinical audit from Papua, Indonesia. BMC Medicine. 2014;12(1):217. 30.Magris M, Rubio-Palis Y, Alexander N, Ruiz B, Galvan N, Frias D et al. Community-randomized trial of lambdacyhalothrin-treated hammock nets for malaria control in Yanomami communities in the Amazon region of Venezuela. Tropical Medicine & International Health. 2007;12(3):392-403. 31.Sochantha T, Van Bortel W, Savonnaroth S, Marcotty T, Speybroeck N, Coosemans M. Personal protection by long-lasting insecticidal hammocks against the bites of forest malaria vectors. Tropical Medicine & International Health. 2010;15(3):336–341 32.Thang ND, Erhart A, Speybroeck N, Xa NX, Thanh NN, Ky PV et al. Long-Lasting Insecticidal Hammocks for controlling forest malaria: a community-based trial in a rural area of central Vietnam. PLoS one. 2009;4(10):e7369. 33.Rowland M, Downey G, Rab A, Freeman T, Mohammad N, Rehman H et al. DEET mosquito repellent provides personal protection against malaria: a household randomized trial in an Afghan refugee camp in Pakistan. Tropical Medicine & International Health. 2004;9(3):335–342. 34.Rowland M, Durrani N, Hewitt S, Mohammed N, Bouma M, Carneiro I et al. Permethrin-treated chaddars and top-sheets: appropriate technology for protection against malaria in Afghanistan and other complex emergencies. Transactions of the Royal Society of Tropical Medicine and Hygiene. 1999;93(5):465-472. 35.Chen-Hussey V, Carneiro I, Keomanila H, Gray R, Bannavong S, Phanalasy S et al. Can topical insect repellents reduce malaria? A cluster-randomised controlled trial of the insect repellent N,N-diethyl-m-toluamide (DEET) in Lao PDR. PLoS one. 2013;8(8):e70664. 36.Deressa W, Yihdego YY, Kebede Z, Batisso E, Tekalegne A, Dagne GA. Effect of combining mosquito repellent and insecticide treated net on malaria prevalence in Southern Ethiopia: A cluster-randomised trial. Parasites & Vectors. 2014;7(1):132. 37.Tusting LS, Thwing J, Sinclair D, Fillinger U, Gimnig J, Bonner KE et al. Mosquito larval source management for controlling malaria. Cochrane Database of Systematic Reviews. 2013;8:CD008923. 38.Hewitt S, Rowland M. Control of zoophilic malaria vectors by applying pyrethroid insecticides to cattle. Tropical Medicine & International Health. 1999;4(7):481-486. 39.Mahande AM, Mosha FW, Mahande JM, Kweka EJ. Role of cattle treated with deltamethrine in areas with a high population of Anopheles arabiensisin Moshi, Northern Tanzania. Malaria Journal. 2007;6(1):109. 40.Messenger LA, Matias A, Manana AN, Stiles-Ocran JB, Knowles S, Boakye DA et al. Multicentre studies of insecticide-treated durable wall lining in Africa and South-East Asia: entomological ecacy and household acceptability during one year of eld use. Malaria Journal. 2012;11(1):358. 41.Mittal PK, Sreehari U, Razdan RK, Dash AP. Evaluation of the impact of ZeroFly(R), an insecticide incorporated plastic sheeting on malaria incidence in two temporary labour shelters in India. Journal of Vector Borne Diseases. 2011;48(3):138-143. 42.WHO. Insecticide-treated mosquito nets: A WHO position statement. Geneva, World Health Organization (WHO). 2007. 43.WHO. Indoor residual spraying: An operational manual for IRS for malaria transmission, control and elimination. Geneva, World Health Organization (WHO). 2013. 44.WHO. Guidance for countries on combining indoor residual spraying and long-lasting insecticidal nets. Geneva, World Health Organization (WHO). 2014. 45.WHO. Larval source management: A supplementary measure for malaria vector control. An operational manual. Geneva, World Health Organization (WHO). 2013. 46.Kondrashin A, Baranova AM, Ashley EA, Recht J, White NJ, Sergiev VP. Mass primaquine treatment to eliminate vivax malaria: lessons from the past. Malaria Journal. 2014;13(1):51. 47.Hill DR, Baird JK, Parise ME, Lewis LS, Ryan ET, Magill AJ. Primaquine: report from CDC expert meeting on malaria chemoprophylaxis I. The American Journal of Tropical Medicine and Hygiene. 2006;75(3):402-415. 48.Wongsrichanalai C, Barcus MJ, Muth S, Sutamihardja A, Wernsdorfer WH. A review of malaria diagnostic tools: microscopy and rapid diagnostic test (RDT). The American Journal of Tropical Medicine and Hygiene. 2007;77(6):119-127. 49.WHO/FIND/CDC. Malaria rapid diagnostic test performance. Results of WHO product testing of malaria RDTs: Round 5 (2013). Geneva, World Health Organization (WHO), FIND (Foundation for Innovative New Diagnostics (FIND) and Centers for Disease Control and Prevention (CDC). 2014 50.WHO. Malaria microscopy quality assurance manual, version 1. Manila, World Health Organization (WHO) Western Pacic Regional Oce. 2009. 51.WHO. Basic malaria microscopy: Part I. Learner’s guide. Second edition. Geneva, World Health Organization (WHO). 2010. 52.Peters AL, Van Noorden CJ. Glucose-6-phosphate dehydrogenase deciency and malaria: cytochemical detection of heterozygous G6PD deciency in women. The Journal of Histochemistry and Cytochemistry. 2009;57(11):1003–1011. 53.Padilla CD, Therrell BL, Working Group of the Asia Pacic Society for Human Genetics on Consolidating Newborn Screening E‑orts in the Asia Pacic R. Consolidating newborn screening e‑orts in the Asia Pacic region: Networking and shared education. Journal of Community Genetics. 2012;3(1):35-45. 54.WHO. Global report on antimalarial drug efficacy and drug resistance: 2000-2010. Geneva, World Health Organization (WHO). 2010. 55.Pukrittayakamee S, Imwong M, Singhasivanon P, Stepniewska K, Day NJ, White NJ. Effects of diffrent antimalarial drugs on gametocyte carriage in P. vivax malaria. The American Journal of Tropical Medicine and Hygiene. 2008;79(3):378–384. 56.Howes RE, Piel FB, Patil AP, Nyangiri OA, Gething PW, Dewi M et al. G6PD deciency prevalence and estimates of affected populations in malaria endemic countries: A geostatistical model-based map. PLoS Medicine. 2012;9(11):e1001339. 57.Galappaththy GNL, Omari AAA, Tharyan P. Primaquine for preventing relapses in people with Plasmodium vivax malaria. Cochrane Database of Systematic Reviews. 2007;(1):CD004389. 58.John GK, Douglas NM, von Seidlein L, Nosten F, Baird JK, White NJ et al. Primaquine radical cure of Plasmodium vivax: A critical review of the literature. Malaria Journal. 2012;11(1):280. 59.WHO. Guidelines for the treatment of malaria, Third edition. Geneva, World Health Organization (WHO). 2015. 60.Lança EFC, Magalhaes BML, Vitor-Silva S, Siqueira AM, Benzecry SG, Alexandre MA et al. Risk factors and characterization of Plasmodium vivax - associated admissions to pediatric intensive care units in the Brazilian Amazon. PLoS one. 2012;7(4):e35406. 61.Lampah DA, Yeo TW, Hardianto SO, Tjitra E, Kenangalem E, Sugiarto P et al. Coma associated with microscopy-diagnosed Plasmodium vivax: A prospective study in Papua, Indonesia. PLoS Neglected Tropical Diseases. 2011;5(6):e1032. 62.Tjitra E, Anstey NM, Sugiarto P, Warikar N, Kenangalem E, Karyana M et al. Multidrug-resistantPlasmodium vivax associated with severe and fatal malaria: A prospective study in Papua, Indonesia. PLoS Medicine. 2008;5(6):e128. 63.WHO. Methods for surveillance of antimalarial drug efficacy. Geneva, WHO, 2009. 64.Rieckmann KH, Davis DR, Hutton DC. Plasmodium vivax resistance to chloroquine? Lancet. 1989; 2(8673):1183–1184 65.Baird JK. Resistance to therapies for infection by Plasmodium vivax. Clinical Microbiology Reviews. 2009;22(3):508–534. 66.Charoenlarp P, Harinasuta T. Relapses of vivax malaria after a conventional course of primaquine and chloroquine: report of 2 cases. The Southeast Asian Journal of Tropical Medicine and Public Health. 1973;4(1):135–137. 67.Goller JL, Jolley D, Ringwald P, Biggs BA. Regional differences in the response of Plasmodium vivax malaria to primaquine as anti-relapse therapy. The American Journal of Tropical Medicine and Hygiene. 2007;76(2):203-207. 68.Bennett JW, Pybus BS, Yadava A, Tosh D, Sousa JC, McCarthy WF et al. Primaquine failure and cytochrome P-450 2D6 in Plasmodium vivax malaria. The New England Journal of Medicine. 2013;369(14):1381–1382. 69.Sharrock WW, Suwanarusk R, Lek-Uthai U, Edstein MD, Kosaisavee V, Travers T et al. Plasmodium vivax trophozoites insensitive to chloroquine. Malaria Journal. 2008;7(1):94 70.WHO. Disease surveillance for malaria control. Geneva, World Health Organization (WHO). 2012 71.WHO. Disease surveillance for malaria elimination: An operational manual. Geneva, World Health Organization (WHO). 2012. 72.WHO. Malaria vaccine technology roadmap. Geneva, World Health Organization (WHO). 2013 73.WHO. Global Technical Strategy for Malaria 2016–2030. Geneva, World Health Organization (WHO). 2015.
|

