|
Lộ trình phát triển và đánh giá của Tổ chức Y tế Thế giới về phát triển lâm sàng vắc xin sốt rét
Tiến bộ trong việc phát triển vắc xin sốt rét và sinh phẩm sinh học đã tăng tốc trong những năm gần đây. Nguồn tài trợ và nhận thức ngày càng tăng cũng như những tiến bộ trong khoa học và công nghệ vắc xin đã tiếp thêm sinh lực cho một lĩnh vực vốn bị hạn chế do thiếu thị trường truyền thống, ít nhà phát triển và sự phức tạp về mặt kỹ thuật trong việc phát triển bất kỳ loại vắc xin hoặc chế phẩm sinh học nào chống lại ký sinh trùng. Ngay cả với tiến bộ này, lĩnh vực này vẫn cần những ý tưởng mới, nhiều nguồn tài trợ hơn và quan hệ đối tác sáng tạo. Được dẫn dắt bởi Tổ chức Y tế Thế giới, các nhà tài trợ hàng đầu thế giới cho việc phát triển vắc xin sốt rét đã phát triển một chiến lược toàn cầu nhằm đẩy nhanh quá trình phát triển vắc xin sốt rét.Chiến lược lộ trình công nghệ vắc xin sốt rét, có tầm nhìn phát triển và cấp phép cho các loại vắc xin an toàn và hiệu quả để ngăn ngừa bệnh tật và tử vong, đồng thời ngăn ngừa sự lây truyền ký sinh trùng sốt rét để có thể loại trừcăn bệnh này. Nhóm tài trợ vắc xin sốt rét lần đầu tiên công bố lộ trình vào năm 2006 và cập nhật vào năm 2013. Lộ trình vạch ra con đường hướng tới mục tiêu tạm thời là phát triển và cấp phép cho vắc xin thế hệ đầu tiên vào năm 2015 có hiệu quả bảo vệ hơn 50% chống lại bệnh nặng và tử vong và kéo dài hơn một năm.Lộ trình này cũng kêu gọi phát triển vắc-xin chống lại hai loại bệnh sốt rét gây ra mối đe dọa lớn nhất trên thế giới—sốt rét Plasmodium falciparum, loại bệnh chiếm ưu thế ở châu Phi và gây ra nhiều ca tử vong nhất trên toàn cầu, và bệnh sốt rét Plasmodium vivax lan rộng hơn, hiện đang phổ biến hơn, được tìm thấy ở nhiều nước ngoài Châu Phi. Chiế lược vạch ra lộ trình cấp phép vắc xin nhắm mục tiêu P. falciparum và P. vivax vào năm 2030 và bao gồm hai mục tiêu: §Phát triển vắc xin sốt rét có hiệu quả bảo vệ ít nhất 75% đối với bệnh sốt rét lâm sàng. §Phát triển vắc xin sốt rét làm giảm sự lây truyền ký sinh trùng nhằm giảm đáng kể tỷ lệ mắc bệnh sốt rét ở người. 
Nguồn: WHO: Malaria Vaccine Technology Roadmap
Các vắc xin sốt rét hiện đang được phát triển lâm sàng nhắm vào các giai đoạn khác nhau của vòng đời ký sinh trùng, bao gồm giai đoạn tiền hồng cầu (nhắm vào các kháng nguyên ở giai đoạn gan hoặc thoa trùng), giai đoạn vô tính và giai đoạn hữu tính, bào tử hoặc muỗi (nhắm vào các giao tử trước khi thụ tinh/ giao tử hoặc hợp tử/ookinete sau thụ tinh). Một loạt thử nghiệm lâm sàng đầy đủ dành cho một ứng viên vắc xin thành công có thể mất từ 10 đến 12 năm, có sự tham gia của 50.000 đến 100.000 tình nguyện viên và tiêu tốn từ 500 triệu USD trở lên. Rất ít loại vắc xin có thể tồn tại được trong quá trình nghiêm ngặt này, đó là một lý do khiến hoạt động nghiên cứu và phát triển dược phẩm (R&D) rất tốn kém. Việc tạo ra vắc-xin sốt rét cho trẻ nhỏ và phụ nữ mang thai-một trong những thách thức phát triển vắc-xin quan trọng nhất hiện nay-cũng không phải là ngoại lệ. Tuy nhiên, các nhà phát triển vắc xin sốt rét tin tưởng rằng mục tiêu sẽ đạt được và đã nhìn thấy những kết quả đầy hứa hẹn. 
Hình 1. Quy trình thử nghiệm lâm sàng vắc xin
Nguồn: Clinical trials: Steps in malaria vaccine development, malaria vaccine initative, PATH.
Tổ chức Y tế Thế giới đã phân tích hệ thống vắc xin sốt rét đang ở giai đoạn phát triển lâm sàng giai đoạn I-IV (tính đến tháng 12 năm 2023). Các sản phẩm được báo cáo theo trạng thái vắc xin (hoạt động/không hoạt động), giai đoạn phát triển lâm sàng cao nhất, loài sốt rét mục tiêu, giai đoạn vòng đời mục tiêu, nền tảng vắc xin, kháng nguyên đích và tá dược. Các thử nghiệm được báo cáo theo quốc gia nơi thử nghiệm được tiến hành, tình trạng thử nghiệm, Khu vực của WHO và nhóm thu nhập. Nghiên cứu về vắc xin được coi là đang hoạt động nếu bất kỳ hoạt động phát triển lâm sàng nào đã diễn ra trong 3 năm qua, chúng được liệt kê trong danh sách của nhà phát triển là đang hoạt động hoặc chúng được các chuyên gia được tư vấn xác nhận là đang hoạt động. Các ứng viên được xác định là không hoạt động nếu không có hoạt động phát triển lâm sàng nào được xác định trong 3 năm qua hoặc các chuyên gia xác định họ là không hoạt động. 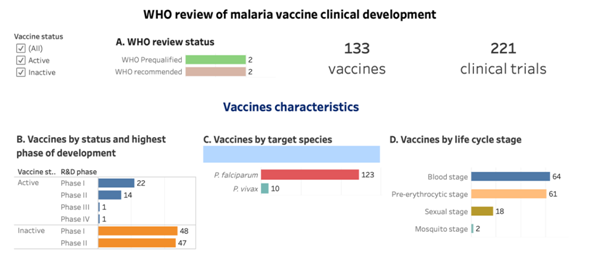
Nguồn: WHO (2024), “WHO review of malaria vaccine clinical development”.
Hiện nay đã có 133 vắc xin đang được nghiên cứu trên toàn thế giới, trong đó có thể thấy, vắc xin tập trung vào hai loài Plasmodium phổ biến là P.falciparum và P.vivax. Nhiều nhất vẫn là P.falciparum với 123 vắc xin và 10 sản phẩm vắc xin cho P.vivax. Tổng cộng có 221 thử nghiệm vắc xin sốt rét đã được hoàn thành hoặc bắt đầu kể từ năm 2002, trong đó24 thử nghiệm đang diễn ra đối với vắc xin đang được phát triển tích cực.Các thử nghiệm lâm sàng hiện nay đang được thử nghiệm ở rất nhiều các khu vực khác nhau trên thế giới, bao gồm Châu Phi, Châu Mỹ, Châu Âu, Tây Thái Bình Dương và Đông Nam Á. Trong đó gần một nửa (102; 46%) đã được hoàn thành hoặc đang diễn ra tại 13 quốc gia trong khu vực Châu Phi của WHO (biểu đồ H). 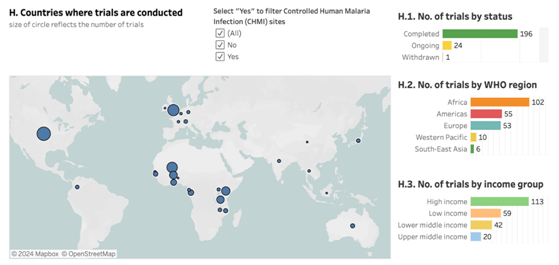
Nguồn: WHO (2024), “WHO review of malaria vaccine clinical development”.
Trong số 133 loại vắc xin sốt rét đang được phát triển lâm sàng thì có hai loại vắc xin đã được WHO sơ tuyển và khuyến cáo sử dụng- RTS,S/AS01E và R21/Matrix-M.RTS,S/AS01 (RTS,S) là vắc xin sốt rét đầu tiên trên thế giới và là vắc xin đầu tiên được phê duyệt để chống lại bệnh ký sinh trùng ở người. Vắcxin dành cho trẻ em này có tác dụng chống lại Plasmodium falciparum, loại ký sinh trùng sốt rét nguy hiểm nhất trên toàn cầu và phổ biến nhất ở Châu Phi. Vắcxin làm giảm số lần trẻ mắc bệnh sốt rét, bao gồm cả bệnh sốt rét nghiêm trọng, đe dọa tính mạng và làm giảm tỷ lệ tử vong ở trẻ em.WHO khuyến cáo nên sử dụng vắcxin này như một công cụ bổ sung để phòng ngừa sốt rét do P. falciparum ở trẻ em sống ở các khu vực có mức độ lan truyền bệnh sốt rét từ trung bình đến cao. PATH đã tham gia phát triển và giới thiệu vắc xin RTS,S từ năm 2001. Theo phân tích của WHO, trong số 38 loại vắc xin đang ở trạng thái "hoạt động" đang phát triển lâm sàng thì hơn một nửa (22; 58%) ở giai đoạn I, một phần ba (14; 37%) ở giai đoạn II, một ở giai đoạn III và một (RTS,S/AS01E) ở giai đoạn IV (biểu đồ B).87% (33 vắc xin) có mục tiêu cho Plasmodium falciparum và 13% (5 vắc xin) có mục tiêu cho Plasmodium vivax(biểu đồ C).Khoảng một nửa (17; 45%) nhắm đến giai đoạn tiền hồng cầu, tiếp theo là giai đoạn máu (15; 40%) và giai đoạn hữa tính (9; 24%) (biểu đồ D).Hai phần ba là vắc xin tiểu đơn vị tái tổ hợp (25; 66%). Tiếp theo là các hạt giống vi rút (7; 18%) và nền tảng vắc xin tái tổ hợp có vectơ vi rút (5; 13%) (biểu đồ E).17 loại kháng nguyên khác nhau đã được nhắm mục tiêu, trong đó PfCSP là phổ biến nhất (13; 34%) (biểu đồ F).Trong số chín tá dược khác nhau được sử dụng, hai tá dược được sử dụng trong hai loại vắc xin được WHO khuyến nghị là AS01E (RTS,S) và Matrix M1 (R21). 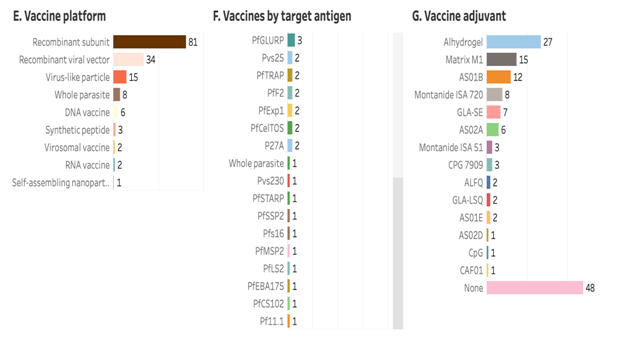
Nguồn: WHO (2024), “WHO review of malaria vaccine clinical development”.
Công cuộc phát triển vắcxin sốt rét thế hệ tiếp theo sẽ tập trung vào việc tăng hiệu quả, độ bền hoặc khả năng bảo vệ và giảm số lượng liều cần thiết. Những loại vắc xin như vậy có khả năng mang lại tác động lớn hơn trong việc ngăn ngừa bệnh tật và tử vong ở những đối tượng dễ bị tổn thương nhất so với những vắc xin thế hệ đầu tiên. Ngoài ra, nếu chúng có thể mang lại sự bảo vệ ở mức độ cao thành công ở mọi nhóm tuổi thì chúng có tiềm năng giúp đẩy nhanh quá trình loại trừ bệnh sốt rét.
Tài liệu tham khảo
1.PATH (2017), “Clinical trials: Steps in malaria vaccine development”. 2.WHO (2024), “WHO review of malaria vaccine clinical development”. 3.WHO (2023), “World malaria report 2022”. 4.WHO (2013), “Malaria Vaccine Technology Roadmap”.
|

