
 |
|
|
Thứ 6, ngày 22/11/2024 |
|
|||||||||||||||
|
Lâm sàng và chẩn đoánKhám thực thểKhám thực thể hiếm khi giúp cho thầy thuốc phân biệt viêm não màng não do amip với các bệnh lý trên hệ thần kinh trung ương. Các thăm khám chuyên khoa thần kinh nên đưa ra. Viêm não màng não do amip tiên phát (PAM)Các bệnh nhân khai có thay đổi hay bất thường về vị giác và khứu giác. Các dấu chứng khác của PAM gồm có sốt, sợ ánh sáng, cứng cổ, rối loạn tâm thần và động kinh, co giật. Nhiễm trùng dạng PAM có thể tiến triển nhanh chóng khi có bằng chứng tăng áp lực sọ não và tụt kẹt/ thoát vị não. Hiếm hơn, các triệu chứng viêm cơ tim cũng có thể xảy ra, mặc dù amip không có mặt ơt trong cơ tim. Viêm não do amip dạng hạt (GAE)Các đối tượng mắc GAE có thể có sốt nhẹ, sợ ánh sáng hoặc cứng cổ. Các thăm khám bệnh nhân có thể phát hiện liệt dây thần kinh sọ não, liệt nửa người, mất ngôn ngữ, thất điều hoặc song thị, ngoài ra còn có các cơn động kinh cục bộ. Các bệnh nhân mắc GAE có thể biểu hiện các triệu chứng tăng áp lực sọ não và thoát vị não. Viêm giác mạc – kết mạc trên các bệnh nhân mang kính sát tròng, hoặc tổn thương da có thể hiếm khi xảy ra. Sự cân nhắc về chẩn đoánCác tình trạng hoặc bệnh lý cần cân nhắc trong chẩn đoán phân biệt viêm não màng não do amip với các bệnh sau:
Chẩn đoán phân biệt
|  |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
Sinh thiết và các mẫu bệnh phẩm khi phẩu tích tử thi từ các bệnh nhân mắc PAM biểu hiện viêm mạnh, với sự xâm nhập các bạch cầu đa nhân trung tính, xuất huyết và hình ảnh hoại tử đặc trưng của viêm màng não cấp. Các kháng thể huỳnh quang có thể giúp xác định nhiều thể tư dưỡng trong mẫu dịch não tủy.
Sinh thiết các thương tổn mô hạt tại chỗ trên các bệnh nhân có thương tổn u hạt có GAE có thể hỗ trợ cho việc thiết lập chẩn đoán. Trên các cá nhân bị GAE, phản ứng mô hạt mức độ vừa biểu hiện liên quan đến mạch máu. Các thể tư dưỡng và nang sẽ có số lượng ít hơn trong PAM, có thể xác định thông qua sử dụng các kháng thể huỳnh quang.
Xét nghiệm PCR trên các bệnh phẩm mô cũng được đề xuất như một công cụ chẩn đoán hỗ trợ trên các bệnh nhân nhiễm amip tự do.
Chụp cắt lớp vi tính não (CT scan) hoặc chụp cộng hưởng từ hạt nhân (MRI) nên thực hiện trước khi chọc dò tủy sống nếu có bằng chứng liên quan đến hệ thần kinh trung ương tại chỗ hoặc tăng áp lực sọ não. Tăng áp lực sọ não biểu hiện và CT scan và MRI biểu hiện sung huyết màng não và phù não.
Các nghiên cứu về chẩn đoán hình ảnh có thể biểu hiện chứng cứ của sự tăng áp lực sọ não hoặc thoát vị não. Tuy nhiên, trên một bệnh nhân có biểu hiện PAM, thì hành khứu giác, thùy thái dương và thùy trán liên quan bệnh có thể tràn lan, lan tỏa.
Trên các cá nhân biểu hiện GAE, các thương tổn tại chỗ rất phổ biến và có thể nhìn thấy khắp hệ thần kinh trung ương.
Như đã đề cập ở trên, chọc dò tủy sống để phân tích dịch não tủy là công cụ chẩn đoán đầu tiên trong bệnh lý PAM. Phân tích dịch não tủy khó có thể phân biệt với các bệnh lý viêm màng não cấp do vi khuẩn, ngoại trừ nhuộm giêm sa luôn luôn âm tính.
Tăng bạch cầu đa nhân trung tính là điểm nổi bật, với tăng nồng độ protein, giảm nồng độ glucose và có hồng cầu xuất hiện.
Nếu nghi ngờ bệnh nhân mắc PAM, kính hiển vi với pha tương phản trên dịch não tủy có thể cho thấy các thể tư dưỡng di động.
Thực hiện thử nghiệm PCR loại phát hiện 3 tác nhân (triplex real-time polymerase chain reaction assay) để tìm Naegleria, Acanthamoeba, Balamuthia đã được phát triển xây dựng bởi trung tâm phòng chống bệnh tật (CDC_Centers for Disease Control and Prevention). Multiplex PCR xét nghiệm các tác nhân ở trên và đối với các loài Sappinia có thể khắc phục những gì sẵn có trong tương lai sắp đến.
Tương tự với PAM, chọc dò tủy sống để phân tích dịch não tủy là một công cụ chẩn đoán đầu tiên trong GAE. Phân tích dịch não tủy biểu hiện cho thấy ít có phản ứng viêm hơn so với các bệnh nhân mắc bệnh lý PAM và không có thể tư dưỡng xuất hiện trọng dịch não tủy, đồng thời áp lực mở tăng lên.
Phân tích dịch não tủy tương tự như trong viêm màng não vô trùng, với chỉ số bạch cầu đơn nhân lượng thấp đến vừa; nồng độ protein tăng và thường có nồng độ glucose hơi giảm nhẹ hoặc bình thường.
Các bệnh nhân viêm não màng não do amip nhập viện vào khoa chăm sóc tích cực để giám sát và điều trị. Sắp xếp chuyển bệnh nhân nếu các chuyên gia điều trị thích hợp và nguồn lực không sẵn có tại tuyến điều trị. Cụ thể, nhiễm trùng PAM sẽ diễn tiến như một bệnh lý viêm màng não cấp do vi khuẩn nghiêm trọng không đáp ứng với các thuốc kháng sinh thông thường.
Lựa chọn điều trị đối với bệnh lý PAM là thuốc amphotericin B, ở liều dung nạp tối đa với chế phẩm rifampin và doxycycline thêm vào. Điều trị thành công cũng có thể đòi hỏi thuốc amphotericin B đưa vào trong khoang nhện. Sulfisoxazole, phenothiazine và artemisinin có thể có một số lợi điểm. Ngoài ra, các nghiên cứu cũng đã cho thấy vai trò azithromycin như một thuốc bổ sung cho phác đồ thuốc amphotericin B.
Trên các nghiên cứu in vitro và trên mô hình chuột đã cho thấy thuốc miltefosine, chlorpromazine và rokitamycin có thể có hoạt tính điều trị PAM. Tuy nhiên, hiệu quả của các thuốc điều trị này vẫn chưa chứng minh.
Ketoconazole và amphotericin B (dùng đơn thuần hay phối hợp), cũng như sulfadiazine có thể chỉ định trong bệnh lý GAE. Một báo cáo ca bệnh mô tả được điều trị thành công bệnh lý Balamuthia GAE bằng thuốc miltefosine, fluconazole và albendazole. Báo cáo ca bệnh khác mô tả điều trị thành công Acanthamoeba GAE bằng thuốc trimethoprim-sulfamethoxazole (TMP-SMZ), fluconazole, pentamidine, miltefosine và oxy cao áp. Cuối cùng, một phác đồ thuốc phối hợp voriconazole và miltefosine được sử dụng xem xét chỉ định.
Viêm não màng não do amip tiên phát (PAM)
PAM có thể đòi hỏi sự thay thế của một ổ chứa tác nhân cho thuốc amphotericin B đưa vào trong khoang nhện hay miconazole. Não úng thủy có thể cần thiết đặt shunt. 
Viêm não do amips dạng hạt (GAE)
Sinh thiết có thể cho phép chẩn đoán. Phẩu tích các thương tổn dính hoặc cô lập có thể có ích đối với các cá nhân mắc GAE. Não úng thủy có thể cần thiết đặt shunt.
Cần có sự tư vấn cấp thời với các chuyên gia bệnh nhiễm trùng, các nhà thần kinh lâm sàng và phẩu thuật thần kinh nếu thấy nghi ngờ bệnh nhân mắc PAM hoặc GAE.
Các biện pháp ngăn ngừa bệnh lý PAM và GAE bao gồm như sau:
Amphotericin B là thuốc lựa chọn trong điều trị PAM, bổ sung thêm thuốc rifampin và doxycycline. Amphotericin B và /hoặc ketoconazole là các thuốc được chỉ định cho các bệnh nhân có bệnh lý GAE. Các nghiên cứu chỉ ra thuốc azithromycin có thể mang lại lợi điểm trên các bệnh lý PAM.
Các thuốc kháng sinh chống lại amip khác nhau và thuốc chống nấm được sử dụng trong phối hợp và liều tối đa cũng như đường dùng ngoài đường uống hoặc qua khoang nhện. Tăng áp lực sọ não và cơn động kinh nên được quản lý và giám sát khi cần thiết. Một báo cáo ca bệnh cho thấy rằng liệu pháp thuốc phối hợp đường uống đối với bệnh viêm màng não Acanthamoeba có thể thành công, nhưng kết quả này chưa thấy đăng tải.
Amphotericin B là một thuốc diệt amip ở liều thấp. Người ta dựa trên nền tảng điều trị tất cả bệnh nhân PAM còn sống và cũng được sử dụng đối với bệnh GAE. Thuốc này hiện vẫn được xem là thuốc lựa chọn cho cả hai bệnh trong điều kiện các thuốc khác đang trong giai đoạn nghiên cứu. Mặc dù một số dữ liệu sẵn có, sử dụng một trong các công thức lipid ở liều tối đa được khuyến cáo vì về mặt lý thuyết các hóa chất dựa trên nền lipid cho phép phân bố liều cao hơn với độc tính thấp hơn.
Một trong số 3 công thức chế phẩm lipid của amphotericin B, không có dữ liệu liên quan đến hiệu lực, tính an toàn hay liều sẵn có đối với bệnh lý PAM hoặc GAE. Không có cơ sở lựa chọn trong số chúng được công nhận. Mặc dù thiếu dữ liệu hỗ trợ cho việc sử dụng các chế phẩm này cho điều trị viêm não màng não do amip, tuy nhiên chúng được khuyến cáo dùng vì dự hậu rất nghiêm trọng của bệnh như một cứu cánh.
Đây là một chế phẩm lipid gồm có amphotericin B bên trong unilamellar liposomes. Thuốc phân bố nồng độ cao hơn và tăng tiềm năng điều trị cũng như giảm độc tính của thuốc trên thận.
Amphotericin B là một loại kháng sinh polyene có sinh khả dụng đường uống kém. Nó được tạo ra bởi chủng Streptomyces nodosus, nó có thể có tính kìm nấm hoặc diệt nấm. Thuốc gắn kết với sterols (ví dụ ergosterol) trong màng tế bào nấm, gây nên sự thoát ra các thành phần nội bào và gây chết tế bào nấm. Độc tính đối với các tế bào ở người có thể xảy ra theo cùng một cơ chế này.
Amphotericin B colloidal dispersion cũng là một chế phẩm lipid gồm có amphotericin B gắn với cấu trúc lipid hình đĩa. Amphotericin B là một loại kháng sinh polyene antibiotic có sinh khả dụng đường uống kém. Thuốc được tạo ra bởi chủng Streptomyces nodosus và nó có thể là chất kìm nấm hay diệt nấm. Thuốc gắn kết với các sterols (như ergosterol) trong màng tế bào nấm, dẫn đến làm rò rỉ các thành phần nội bào và gây chết tế bào nấm. Độc tính đối với các tế bào ở người cũng có thể xảy ra thông qua cơ chế này.
Rifampin has amebicidal activity in vitro and is synergistic with amphotericin B when administered intravenously. It inhibits ribonucleic acid (RNA) synthesis in bacteria by binding to the beta subunit of deoxyribonucleic acid (DNA) - dependent RNA polymerase, which, in turn, blocks RNA transcription.
Doxycycline có hoạt tính diệt amip trên in vitro và hiệp lực với amphotericin B khi chỉ định thuốc này theo đường tiêm tĩnh mạch. Thuốc ức chế sinh tổng hợp protein và do đó sự phát triển của vi khuẩn do gắn kết với 30S và 50S ribosomal subunits của các vi khuẩn còn nhạy cảm.
Thuốc phối hợp erythromycin và sulfisoxazole hấp thu tốt qua đường tiêu hóa nhưng thuốc chỉ định tốt nhất khi sau khi ăn no để tránh các tình trạng khó chịu hệ tiêu hóa. Erythromycin ức chế sự tổng hợp protein vi khuẩn. Sulfisoxazole ức chế sự tổng hợp các folic acid từ para-aminobenzoic acid trong vi khuẩn.
Ketoconazole là một loại imidazole chống amip, khi phối hợp với amphotericin B lại là thuốc lựa chọn đối với bệnh lý GAE. Thuốc này ức chế tổng hợp ergosterol, cho phép các thành phần của tế bào thoát rỉ, do đó dẫn đến chết tế bào. 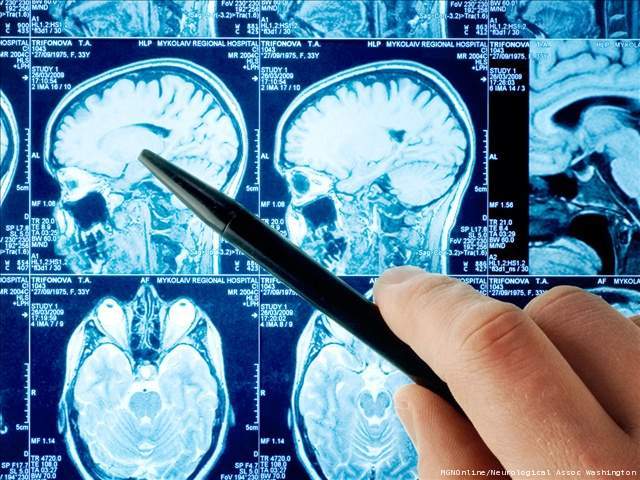
Sulfadiazine có hoạt tính diệt amip trên in vitro và hiệp lực với ketoconazole và /hoặc amphotericin B. Thuốc có tác dụng kìm khuẩn tốt thông qua cơ chế đối kháng cạnh tranh của PABA.
Azithromycin tác động nhờ vào sự gắn kết với tiểu đơn vị 50S ribosomal subunit của các vi sinh vật nhạy cảm và ngăn cản sự phân ly của các peptidyl transfer RNA (tRNA) từ ribosome; điều này gây ra làm dừng tiến trình tổng hợp protein lệ thuộc RNA. Quá trình tổng hợp nucleic acid không bị ảnh hưởng.
Azithromycin tập trung trong các thể thực bào và nguyên bào sợi như biểu hiện trong kỹ thuật nuôi cấy ủ trên in vitro. Các nghiên cứu trên in vivo cho thấy rằng nồng độ trong các thể thực bào có thể góp phần vào khâu phân bố thuốc đến các mô viêm. Azithromycin điều trị các nhiễm nhẹ đến vừa. nó có thể có vài trò thay thế phụ trợ cho amphotericin B trong điều trị GAE/PAM.
Tài liệu tham khảo
1.Cermeno JR, Hernandez I, El Yasin H, et al. Meningoencephalitis by Naegleria fowleri: epidemiological study in Anzoategui state,
2.Bakardjiev A, Azimi PH, Ashouri N, et al. Amebic encephalitis caused by Balamuthia mandrillaris: report of four cases. Pediatr Infect Dis J. May 2003;22(5):447-53. [Medline].
3.Marciano-Cabral F. Free-living amoebae as agents of human infection. J Infect Dis. Apr 15 2009;199(8):1104-6. [Medline].
4.Deetz TR, Sawyer MH, Billman G, et al. Successful treatment of Balamuthia amoebic encephalitis: presentation of 2 cases. Clin Infect Dis. Nov 15 2003;37(10):1304-12. [Medline].
5.Craun GF, Calderon RL, Craun MF. Outbreaks associated with recreational water in the
6.Siddiqui R, Emes R, Elsheikha H, Khan NA. Area 51: How do Acanthamoeba invade the central nervous system?. Trends Parasitol. May 2011;27(5):185-9. [Medline].
7.Shakoor S, Beg MA, Mahmood SF, Bandea R, Sriram R, Noman F, et al. Primary Amebic Meningoencephalitis Caused by Naegleria fowleri, Karachi, Pakistan. Emerg Infect Dis. Feb 2011;17(2):258-61. [Medline].
8.Siddiqui R, Khan NA. Is ritual cleansing a missing link between fatal infection and brain-eating amoebae?. Clin Infect Dis. Jun 2012;54(12):1817-8. [Medline].
9.Yoder JS, Straif-Bourgeois S, Roy SL, Moore TA, Visvesvara GS, Ratard RC, et al. Primary amebic meningoencephalitis deaths associated with sinus irrigation using contaminated tap water. Clin Infect Dis. Nov 2012;55(9):e79-85. [Medline].
10.Yoder JS, Eddy BA, Visvesvara GS, Capewell L, Beach MJ. The epidemiology of primary amoebic meningoencephalitis in the
11.
12.Schuster FL, Yagi S, Gavali S, Michelson D, Raghavan R, Blomquist I, et al. Under the radar: balamuthia amebic encephalitis. Clin Infect Dis. Apr 1 2009;48(7):879-87. [Medline].
13.Baldursson S, Karanis P. Waterborne transmission of protozoan parasites: review of worldwide outbreaks - an update 2004-2010. Water Res. Dec 15 2011;45(20):6603-14. [Medline].
14.Bravo FG, Alvarez PJ, Gotuzzo E. Balamuthia mandrillaris infection of the skin and central nervous system: an emerging disease of concern to many specialties in medicine. Curr Opin Infect Dis. Apr 2011;24(2):112-7. [Medline].
15.Simoes RO, Monteiro FA, Sanchez E, Thiengo SC, Garcia JS, Costa-Neto SF. Endemic angiostrongyliasis, Rio de Janeiro, Brazil. Emerg Infect Dis. Jul 2011;17(7):1331-3. [Medline].
16.Qvarnstrom Y, Visvesvara GS, Sriram R, da Silva AJ. Multiplex real-time PCR assay for simultaneous detection of Acanthamoeba spp., Balamuthia mandrillaris, and Naegleria fowleri. J Clin Microbiol. Oct 2006;44(10):3589-95. [Medline]. [Full Text].
17.Chang HJ, Zuccotti G. Frontal headache. JAMA. Jul 20 2011;306(3):317-8. [Medline].
18.Qvarnstrom Y, da Silva AJ,
19.Goswick SM, Brenner GM. Activities of azithromycin and amphotericin B against Naegleria fowleri in vitro and in a mouse model of primary amebic meningoencephalitis. Antimicrob Agents Chemother. Feb 2003;47(2):524-8. [Medline]. [Full Text].
20.Soltow SM, Brenner GM. Synergistic activities of azithromycin and amphotericin B against Naegleria fowleri in vitro and in a mouse model of primary amebic meningoencephalitis. Antimicrob Agents Chemother. Jan 2007;51(1):23-7. [Medline].
21.Martínez DY, Seas C, Bravo F, Legua P, Ramos C, Cabello AM, et al. Successful Treatment of Balamuthia mandrillaris Amoebic Infection with Extensive Neurological and Cutaneous Involvement. Clin Infect Dis. Jun 15 2010;[Medline].
22.Maritschnegg P, Sovinz P, Lackner H, Benesch M, Nebl A, Schwinger W. Granulomatous amebic encephalitis in a child with acute lymphoblastic leukemia successfully treated with multimodal antimicrobial therapy and hyperbaric oxygen. J Clin Microbiol. Jan 2011;49(1):446-8. [Medline].
23.Webster D, Umar I, Kolyvas G, Bilbao J, Guiot MC, Duplisea K, et al. Treatment of granulomatous amoebic encephalitis with voriconazole and miltefosine in an immunocompetent soldier. Am J Trop Med Hyg. Oct 2012;87(4):715-8. [Medline]. [Full Text].
24.AAP. Amebic meningoencephalitis and keratitis. In: Red Book: 2009 Report of the Committee on Infectious Diseases. 28th. 2009:208-10.
25.Akpek G, Uslu A, Huebner T, Taner A, Rapoport AP, Gojo I, et al. Granulomatous amebic encephalitis: an under-recognized cause of infectious mortality after hematopoietic stem cell transplantation. Transpl Infect Dis. Aug 2011;13(4):366-73. [Medline].
26.Apley J,
27.Barratt JL, Harkness J, Marriott D, Ellis JT, Stark D. Importance of nonenteric protozoan infections in immunocompromised people. Clin Microbiol Rev. Oct 2010;23(4):795-836. [Medline].
28.Bloch KC, Schuster FL. Inability to make a premortem diagnosis of Acanthamoeba species infection in a patient with fatal granulomatous amebic encephalitis. J Clin Microbiol. Jun 2005;43(6):3003-6. [Medline]. [Full Text].
29.
30.
31.CDC. Primary amebic meningoencephalitis--
32.Cervantes-Sandoval I, Serrano-Luna Jde J, Garcia-Latorre E, Tsutsumi V, Shibayama M. Characterization of brain inflammation during primary amoebic meningoencephalitis. Parasitol Int. Sep 2008;57(3):307-13. [Medline].
33.Cervantes-Sandoval I, Serrano-Luna Jde J, Meza-Cervantez P, Arroyo R, Tsutsumi V, Shibayama M. Naegleria fowleri induces MUC5AC and pro-inflammatory cytokines in human epithelial cells via ROS production and EGFR activation. Microbiology. Nov 2009;155:3739-47. [Medline].
34.Cha JH, Furie K, Kay J, et al. Case records of the
35.Chotmongkol V, Sawanyawisuth K, Thavornpitak Y. Corticosteroid treatment of eosinophilic meningitis. Clin Infect Dis. Sep 2000;31(3):660-2. [Medline].
36.Chun CS, Kazacos KR, Glaser C, Bardo D, Dangoudoubiyam S, Nash R. Global neurologic deficits with Baylisascaris encephalitis in a previously healthy teenager. Pediatr Infect Dis J. Sep 4 2009;[Medline].
37.Cogo PE, Scagli M, Gatti S, et al. Fatal Naegleria fowleri meningoencephalitis,
38.Diaz JH. Behavioral and recreational risk factors for free-living amebic infections. J Travel Med. Mar-Apr 2011;18(2):130-7. [Medline].
39.Diaz JH. The public health threat from Balamuthia mandrillaris in the southern
40.Durack DT. Amebic infections. In: Infections of the Central Nervous System. 1997:831-44.
41.Dziuban EJ, Liang JL, Craun GF, et al. Surveillance for waterborne disease and outbreaks associated with recreational water--United States, 2003-2004. MMWR Surveill Summ. Dec 22 2006;55(12):1-30. [Medline].
42.Fritzinger AE, Toney DM, MacLean RC, Marciano-Cabral F. Identification of a Naegleria fowleri membrane protein reactive with anti-human CD59 antibody. Infect Immun. Feb 2006;74(2):1189-95. [Medline].
43.Gavin PJ, Shulman ST. Raccoon roundworm (Baylisascaris procyonis). Pediatr Infect Dis J. Jul 2003;22(7):651-2. [Medline].
44.Gelman BB, Rauf SJ, Nader R, et al. Amoebic encephalitis due to Sappinia diploidea. JAMA. May 16 2001;285(19):2450-1. [Medline].
45.Graeff-Teixeira C, da Silva AC, Yoshimura K. Update on eosinophilic meningoencephalitis and its clinical relevance. Clin Microbiol Rev. Apr 2009;22(2):322-48, Table of Contents. [Medline].
46.Grate I Jr. Primary amebic meningoencephalitis: a silent killer. CJEM. Sep 2006;8(5):365-9. [Medline].
47.Gupta N, Bhaskar H, Duggal S, Ghalaut PS, Kundra S, Arora DR. Primary amoebic meningoencephalitis: first reported case from Rohtak,
48.Gyori E. December 2002: 19-year old male with febrile illness after jet ski accident. Brain Pathol. Apr 2003;13(2):237-9. [Medline].
49.Hara T, Fukuma T. Diagnosis of the primary amoebic meningoencephalitis due to Naegleria fowleri. Parasitol Int. Dec 2005;54(4):219-21. [Medline].
50.Hebbar S, Bairy I, Bhaskaranand N, et al. Fatal case of Naegleria fowleri meningo-encephalitis in an infant: case report. Ann Trop Paediatr. 2005;25:223-6. [Medline].
51.Houpt ER, Petri WA Jr. Acanthamoeba species. In: Principles and Practice of Pediatric Infectious Diseases. 2003:1293-5.
52.Huang ZH, Ferrante A, Carter RF. Serum antibodies to Balamuthia mandrillaris, a free-living amoeba recently demonstrated to cause granulomatous amoebic encephalitis. J Infect Dis. May 1999;179(5):1305-8. [Medline].
53.Hughes MA, Petri WA Jr. Naegleria fowleri. In: Principles and Practice of Pediatric Infectious Diseases. 2003:1291-3.
54.Intalapaporn P, Suankratay C, Shuangshoti S, et al. Balamuthia mandrillaris meningoencephalitis: the first case in southeast Asia. Am J Trop Med Hyg. Jun 2004;70(6):666-9. [Medline]. [Full Text].
55.Jayasekera S, Sissons J, Tucker J, et al. Post-mortem culture of Balamuthia mandrillaris from the brain and cerebrospinal fluid of a case of granulomatous amoebic meningoencephalitis, using human brain microvascular endothelial cells. J Med Microbiol. Oct 2004;53(Pt 10):1007-12. [Medline]. [Full Text].
56.Karanis P, Kourenti C, Smith H. Waterborne transmission of protozoan parasites: a worldwide review of outbreaks and lessons learnt. J Water Health. Mar 2007;5(1):1-38. [Medline].
57.Kaushal V, Chhina DK, Ram S, Singh G, Kaushal RK, Kumar R. Primary amoebic meningoencephalitis due to Naegleria fowleri. J Assoc Physicians
58.Kim JH, Jung SY, Lee YJ, et al. Effect of therapeutic chemical agents in vitro and on experimental meningoencephalitis due to Naegleria fowleri. Antimicrob Agents Chemother. Nov 2008;52(11):4010-6. [Medline].
59.Kim JH, Lee YJ, Sohn HJ, et al. Therapeutic effect of rokitamycin in vitro and on experimental meningoencephalitis due to Naegleria fowleri. Int J Antimicrob Agents. Nov 2008;32(5):411-7. [Medline].
60.Krasik EF, Liu C, Visvesvara GS. A 53-year-old woman with rapidly progressive altered mental status and ataxia. Clin Infect Dis. Sep 1 2010;51(5):575-6, 629-30. [Medline].
61.Lakshmi V, Umabala P, Anuradha K, Padmaja K, Padmasree C, Rajesh A, et al. Microbiological spectrum of brain abscess at a tertiary care hospital in South India: 24-year data and review. Patholog Res Int. 2011;2011:583139. [Medline]. [Full Text].
62.Li Q, Yang XH, Qian J. September 2004: a 6-year-old girl with headache and stiff neck. Brain Pathol. Jan 2005;15(1):93-5. [Medline].
63.Lo Re V 3rd, Gluckman SJ. Eosinophilic meningitis due to Angiostrongylus cantonensis in a returned traveler: case report and review of the literature. Clin Infect Dis. Nov 1 2001;33(9):e112-5. [Medline].
64.Ma P, Visvesvara GS, Martinez AJ, et al. Naegleria and Acanthamoeba infections: review. Rev Infect Dis. May-Jun 1990;12(3):490-513. [Medline].
65.Marciano-Cabral F. Advances in free-living amebae research 2006: summary from the IX International Workshop on Opportunistic Protists (IWOP-9). J Eukaryot Microbiol. 2006;53 Suppl 1:S8-9. [Medline].
66.Marciano-Cabral F, Cabral G. Acanthamoeba spp. as Agents of Disease in Humans. Clin Microbiol Rev. Apr 2003;16(2):273-307. [Medline].
67.Marciano-Cabral F, Cabral GA. The immune response to Naegleria fowleri amebae and pathogenesis of infection. FEMS Immunol Med Microbiol. Nov 2007;51(2):243-59. [Medline].
68.Maretic T, Perovic M, Vince A, Lukas D, Dekumyoy P, Begovac J. Meningitis and radiculomyelitis caused by Angiostrongylus cantonensis. Emerg Infect Dis. Jun 2009;15(6):996-8. [Medline].
69.Maurer DM, Greene JP, Vincent JM, et al. Fever, refusal to walk and eosinophilia in a ten-month-old Samoan boy. Pediatr Infect Dis J. Feb 2001;20(2):230-1, 232-3. [Medline].
70.
71.McKee T, Davis L, Blake P. Primary amebic meningoencephalitis--
72.McKellar MS, Mehta LR, Greenlee JE. Fatal granulomatous Acanthamoeba encephalitis mimicking a stroke, diagnosed by correlation of results of sequential magnetic resonance imaging, biopsy, in vitro culture, immunofluorescence analysis, and molecular analysis. J Clin Microbiol. Nov 2006;44(11):4265-9. [Medline].
73.Meersseman W, Lagrou K, Sciot R, de Jonckheere J, Haberler C, Walochnik J. Rapidly fatal Acanthamoeba encephalitis and treatment of cryoglobulinemia. Emerg Infect Dis. Mar 2007;13(3):469-71. [Medline].
74.Mendez O, Kanal E, Abu-Elmagd KM. Granulomatous amebic encephalitis in a multivisceral transplant recipient. Eur J Neurol. Mar 2006;13(3):292-5. [Medline].
75.Moertel CL, Kazacos KR, Butterfield JH, et al. Eosinophil-associated inflammation and elaboration of eosinophil- derived proteins in 2 children with raccoon roundworm (Baylisascaris procyonis) encephalitis. Pediatrics. Nov 2001;108(5):E93. [Medline]. [Full Text].
76.Myint T, Ribes JA, Stadler LP. Photo Quiz. Primary amebic meningoencephalitis. Clin Infect Dis. Dec 2012;55(12):1677, 1737-8. [Medline].
77.Norton R, Harris P, Ryan P, Simpson S. Another killer of the Australian bush: a rapidly fatal meningoencephalitis in a child. Clin Infect Dis. May 15 2010;50(10):1375-6, 1422-4. [Medline].
78.Ondarza RN. Drug targets from human pathogenic amoebas: Entamoeba histolytica, Acanthamoeba polyphaga and Naegleria fowleri. Infect Disord Drug Targets. Sep 2007;7(3):266-80. [Medline].
79.Park SY, Glaser C, Murray WJ, et al. Raccoon roundworm (Baylisascaris procyonis) encephalitis: case report and field investigation. Pediatrics. Oct 2000;106(4):E56. [Medline].
80.Perez MT, Bush LM. Balamuthia mandrillaris Amebic Encephalitis. Curr Infect Dis Rep. Jul 2007;9(4):323-8. [Medline].
81.Perez MT, Bush LM. Fatal amebic encephalitis caused by Balamuthia mandrillaris in an immunocompetent host: a clinicopathological review of pathogenic free-living amebae in human hosts. Ann Diagn Pathol. Dec 2007;11(6):440-7. [Medline].
82.Petry F, Torzewski M, Bohl J, Wilhelm-Schwenkmezger T, Scheid P, Walochnik J, et al. Early diagnosis of Acanthamoeba infection during routine cytological examination of cerebrospinal fluid. J Clin Microbiol. May 2006;44(5):1903-4. [Medline]. [Full Text].
83.Pietrucha-Dilanchian P, Chan JC, Castellano-Sanchez A, Hirzel A, Laowansiri P, Tuda C, et al. Balamuthia mandrillaris and Acanthamoeba amebic encephalitis with neurotoxoplasmosis co-infection in a patient with advanced HIV infection. J Clin Microbiol. Dec 14 2011;[Medline].
84.Radhakrishnan V, Bhatia R, Panda GS, Bakhshi S. Acanthamebic meningoencephalitis presenting as personality change. Pediatr Infect Dis J. Jun 2009;28(6):555. [Medline].
85.Rai R, Singh DK,
86.Reddy R, Vijayasaradhi M, Uppin MS, Challa S, Jabeen A, Borghain R. Acanthamoeba meningoencephalitis in an immunocompetent patient: an autopsy case report. Neuropathology. Apr 2011;31(2):183-7. [Medline].
87.Robertson J, Shilkofski N. Drug doses. In: The Harriet Lane Handbook: A Manual for Pediatric House Officers.
88.Robinson BS, Monis PT, Dobson PJ. Rapid, sensitive, and discriminating identification of Naegleria spp. by real-time PCR and melting-curve analysis. Appl Environ Microbiol. Sep 2006;72(9):5857-63. [Medline].
89.Sandström G, Saeed A, Abd H. Acanthamoeba-bacteria: a model to study host interaction with human pathogens. Curr Drug Targets. Jun 2011;12(7):936-41. [Medline].
90.Schild M, Gianinazzi C, Gottstein B, Muller N. PCR-based diagnosis of Naegleria spp. infection in formalin-fixed and paraffin-embedded brain sections. J Clin Microbiol. Nov 22 2006;[Medline].
91.Schuster FL. Cultivation of pathogenic and opportunistic free-living amebas. Clin Microbiol Rev. Jul 2002;15(3):342-54. [Medline].
92.
93.Schuster FL, Yagi S, Wilkins PP, Gavali S, Visvesvara GS, Glaser CA. Balamuthia mandrillaris, agent of amebic encephalitis: detection of serum antibodies and antigenic similarity of isolates by enzyme immunoassay. J Eukaryot Microbiol. Jul-Aug 2008;55(4):313-20. [Medline].
94.Seidel JS. Naegleria, Acanthamoeba, and Balamuthia. In: Textbook of Pediatric Infectious Diseases. 2004:2748-55.
95.Seidel JS, Harmatz P, Visvesvara GS, et al. Successful treatment of primary amebic meningoencephalitis.
96.Sheng WH, Hung CC, Huang HH, Liang SY, Cheng YJ, Ji DD. First Case of Granulomatous Amebic Encephalitis Caused by Acanthamoeba castellanii in
97.Shirwadkar CG, Samant R, Sankhe M, et al. Acanthamoeba encephalitis in patient with systemic lupus,
98.Singh P, Kochhar R, Vashishta RK, et al. Amebic meningoencephalitis: spectrum of imaging findings. AJNR Am J Neuroradiol. Jun-Jul 2006;27(6):1217-21. [Medline].
99.Singhal T, Bajpai A, Kalra V, et al. Successful treatment of Acanthamoeba meningitis with combination oral antimicrobials. Pediatr Infect Dis J. Jun 2001;20(6):623-7. [Medline].
100.Siripanth C. Amphizoic amoebae: pathogenic free-living protozoa; review of the literature and review of cases in
101.Slom TJ, Cortese MM, Gerber SI, et al. An outbreak of eosinophilic meningitis caused by Angiostrongylus cantonensis in travelers returning from the
102.Stephany JD,
103.Thyssen A, Mitchell M, Qvarnstrom Y, Rao S, Benke TA, Glodé MP. Eosinophilic Meningitis in a Previously Healthy 13-year-old Child. Pediatr Infect Dis J. Feb 2013;32(2):194. [Medline].
104.Tungikar SL, Kulkarni AG, Deshpande AD, Gosavi VS. Primary amebic meningoencephalitis. J Assoc Physicians
105.Tuppeny M. Primary amoebic meningoencephalitis with subsequent organ procurement: a case study. J Neurosci Nurs. Oct 2011;43(5):274-9. [Medline].
106.Vargas-Zepeda J, Gomez-Alcala AV, Vasquez-Morales JA, et al. Successful treatment of Naegleria fowleri meningoencephalitis by using intravenous amphotericin B, fluconazole and rifampicin. Arch Med Res. Jan-Feb 2005;36(1):83-6. [Medline].
107.Visvesvara GS. Amebic meningoencephalitides and keratitis: challenges in diagnosis and treatment. Curr Opin Infect Dis. Dec 2010;23(6):590-4. [Medline].
108.Visvesvara GS, Moura H, Schuster FL. Pathogenic and opportunistic free-living amoebae: Acanthamoeba spp., Balamuthia mandrillaris, Naegleria fowleri, and Sappinia diploidea. FEMS Immunol Med Microbiol. Jun 2007;50(1):1-26. [Medline].
109.Visvesvara GS, Sriram R, Qvarnstrom Y, Bandyopadhyay K, Da Silva AJ, Pieniazek NJ, et al. Paravahlkampfia francinae n. sp. masquerading as an agent of primary amoebic meningoencephalitis. J Eukaryot Microbiol. Jul-Aug 2009;56(4):357-66. [Medline].
110.Walker MD, Zunt JR. Neuroparasitic infections: cestodes, trematodes, and protozoans. Semin Neurol. Sep 2005;25(3):262-77. [Medline].
111.Winiecka-Krusnell, J. Acanthamoeba spp. In: Akuffo H, Linder E, Ljungstrom I, Wahlgren M. Parasites of the Colder Climates.
112.Wiwanitkit V. Review of clinical presentations in Thai patients with primary amoebic meningoencephalitis. Medscape Gen Med. 2004;6(1):[Full Text].
113.Yoder JS, Blackburn BG, Craun GF, et al. Surveillance for waterborne-disease outbreaks associated with recreational water--United States, 2001-2002. MMWR Surveill Summ. Oct 22 2004;53(8):1-22. [Medline].
114.Yoder JS, Hlavsa MC, Craun GF, et al. Surveillance for waterborne disease and outbreaks associated with recreational water use and other aquatic facility-associated health events--United States, 2005-2006. MMWR Surveill Summ. Sep 12 2008;57(9):1-29. [Medline].
115.Marciano-Cabral F, Cabral G. The immune response to Naegleria fowleri amebae and pathogenesis of infection.
116.Healthbeat 2013, Brain-eating warning after Naegleria fowleri amoeba affects 2nd child
117.Marc Lallanilla (2013), Brain-Eating Amoeba Infects 12-Year-Old Girl, http://www.livescience.com
118.Visvesvara GS. Free-living amebae as opportunistic agents of human disease.
119.Yoder JS, Eddy BA, Visvesvara GS, Capewell L, Beach MJ. The epidemiology of primary amoebic meningoencephalitis in the USA, 1962-2008.
120.Seidel J, Harmatz P, Visvesvara GS, Cohen A, Edwards J, Turner J. Successful treatment of primary amebic meningoencephalitis.
121.Vargas-Zepeda J, Gomez-Alcala AV, Vasquez-Morales JA, Licea-Amaya L, De Jonckheere JF, Lores-Villa F. Successful treatment of Naegleria PAM using IV amphotericin B, fluconazole, and rifampin.
122.John DT, John RA. Cytopathogenicity of Naegleria fowleri in mammalian cell cultures.
123.Marciano-Cabral F, Cabral G. The immune response to Naegleria fowleri amebae and pathogenesis of infection.
124.Visvesvara GS. Free-living amebae as opportunistic agents of human disease.
125.Yoder JS, Eddy BA, Visvesvara GS, Capewell L, Beach MJ. The epidemiology of primary amoebic meningoencephalitis in the USA, 1962-2008.
126.Fowler M, Carter RF. Acute pyogenic meningitis probably due to Acanthamoeba sp.: a preliminary report.
127.Butt CG. Primary amebic meningoencephalitis.
128.Gustavo dos Santos Neto. Fatal primary amebic meningoencephalitis. A retrospective study in
129.Visvesvara G, Yoder J, Beach MJ. (2012) Primary amebic meningoencephalitis Chapter 73, pgs 442-447. In: Netter's Infectious Diseases, Eds. Yong EC, Stevens DL. Elsevier Saunders. Philadelphia, PA.
130.Visvesvara GS, Moura H, Schuster FL. Pathogenic and opportunistic free-living amoebae: Acanthamoeba spp., Balamuthia mandrillaris, Naegleria fowleri, and Sappinia diploidea.
131.Chang SL. Resistance of pathogenic Naegleria to some common physical and chemical agents.
132.
133.Tiewchaloren S, Junnu V. Factors affecting the viability of pathogenic Naegleria species isolated from Thai patients.
134.De Jonckheere J, van de Voorde H. Differences in destruction of cysts of pathogenic and nonpathogenic Naegleria and Acanthamoeba by chlorine.
135.Cursons RT, Brown TJ, Keys EA. Effect of disinfectants on pathogenic free-living amoebae: in axenic conditions.
136.Robinson BS, Christy PE. Disinfection of water for control of amoebae. Water. 1984;September:21-4.
137.Sarkar P, Gerba C. Inactivation of Naegleria fowleri by chlorine and ultraviolet light. J AWWA. 2012;104:51-2.
138.Jarroll EL,
139.Rice EW, Hoff JC, Schaefer FW 3rd. Inactivation of Giardia cysts by chlorine.
140.Marciano-Cabral F, Cabral G. The immune response to Naegleria fowleri amebae and pathogenesis of infection.
141.Visvesvara GS. Free-living amebae as opportunistic agents of human disease.
142.Yoder JS, Eddy BA, Visvesvara GS, Capewell L, Beach MJ. The epidemiology of primary amoebic meningoencephalitis in the USA, 1962-2008.
143.
144.Chang SL. Resistance of pathogenic Naegleria to some common physical and chemical agents.
145.Maclean RC, Richardson DJ, LePardo R, Marciano-Cabral F. The identification of Naegleria fowleri from water and soil samples by nested PCR.
146.Wellings FM, Amuso PT, Chang SL, Lewis AL. Isolation and identification of pathogenic Naegleria from Florida lakes.
147.John DT, Howard MJ. Seasonal distribution of pathogenic free-living amebae in Oklahoma waters.
148.Duma RJ. Study of pathogenic free-living amebas in fresh-water lakes in
149.Ettinger MR, Webb SR, Harris SA, McIninch SP, C Garman G, Brown BL. Distribution of free-living amoebae in James River, Virginia, USA.
150.Sheehan KB, Fagg JA, Ferris MJ, Henson JM. PCR detection and analysis of the free-living amoeba Naegleria in hot springs in Yellowstone and Grand Teton National Parks.
151.Sykora JK, Keleti G, Martinez AJ. Occurrence and pathogenicity of Naegleria fowleri in artificially heated waters.
152.Stevens AR, Tyndall RL, Coutant CC, Willaert E. Isolation of the etiological agent of primary amoebic meningoencephalitis from artificially heated waters.
153.Marciano-Cabral F, MacLean R, Mensah A, LaPat-Polasko L. Identification of Naegleria fowleri in domestic water sources by nested PCR.
154.Blair B, Sarkar P, Bright KR, Marciano-Cabral F, Gerba CP. Naegleria fowleri in well water.
155.Yoder JS, Straif-Bourgeois S, Roy SL, Moore TA, Visvesvara GS, Ratard RC, Hill V, Wilson JD, Linscott AJ, Crager R, Kozak NA, Sriram R, Narayanan J, Mull B, Kahler AM, Schneeberger C, da Silva AJ, Beach MJ. Deaths from Naegleria fowleri associated with sinus irrigation with tap water: a review of the changing epidemiology of primary amebic meningoencephalitis.
156.Kemble SK, Lynfield R, DeVries AS, Drehner DM, Pomputius WF 3rd, Beach MJ, Visvesvara GS, da Silva AJ, Hill VR, Yoder JS, Xiao L, Smith KE, Danila R. Fatal Naegleria fowleri infection acquired in Minnesota: possible expanded range of a deadly thermophilic organism.
157.Anderson K, Jamieson A. Primary amoebic meningoencephalitis. Lancet. 1972;1:902–3.
158.Dorsch MM, Cameron AS, Robinson BS. The epidemiology and control of primary amoebic meningoencephalitis with particular reference to South Australia.
159.Puzon GJ, Lancaster JA, Wylie JT, Plumb IJ. Rapid detection of Naegleria fowleri in water distribution pipeline biofilms and drinking water samples.
160.Shakoor S, Beg MA, Mahmood SF, Bandea R, Sriram R, Noman F, et al. Primary amebic meningoencephalitis caused by Naegleria fowleri, Karachi, Pakistan.
161.Gustavo dos Santos Neto. Fatal primary amebic meningoencephalitis. A retrospective study in
162.Kramer MH, Lerner CJ, Visvesvara GS. Kidney and liver transplants from a donor infected with Naegleria fowleri.
163.Bennett WM, Nespral JF, Rosson MW, McEvoy KM. Use of organs for transplantation from a donor with primary meningoencephalitis due to Naegleria fowleri.
164.Tuppeny M. Primary amoebic meningoencephalitis with subsequent organ procurement: a case study.
165.Visvesvara GS, De Jonckheere JF, Sriram R, Daft B.Isolation and molecular typing of Naegleria fowleri from the brain of a cow that died of primary amebic meningoencephalitis.
166.Lozano-Alarcón F, Bradley GA, Houser BS, Visvesvara GS. Primary amebic meningoencephalitis due to Naegleria fowleri in a South American tapir.
167.John DT, Nussbaum SL. Naegleria fowleri infection acquired by mice through swimming in amebae-contaminated water.
168.US Census Bureau. Statistical Abstract of the United States: 2012. Arts, Recreation, and Travel: Participation in Selected Sports Activities 2009.
169.Cabanes PA, Wallet F, Pringuez E, Pernin P. Assessing the risk of primary amoebic meningoencephalitis from swimming in the presence of environmental Naegleria fowleri.
170.Marciano-Cabral F, Cabral G. The immune response to Naegleria fowleri amebae and pathogenesis of infection.
171.Visvesvara GS. Free-living amebae as opportunistic agents of human disease.
172.Council for State and Territorial Epidemiologists (CSTE). Case Definitions for Non-notifiable Infections Caused by Free-living Amebae (Naegleria fowleri, Balamuthia mandrillaris, and Acanthamoeba spp.)
173.Visvesvara GS. Amebic meningoencephalitides and keratitis: challenges in diagnosis and treatment.
174.da Rocha-Azevedo B, Tanowitz HB, Marciano-Cabral F. Diagnosis of infections caused by pathogenic free-living amoebae.
175.Qvarnstrom Y, Visvesvara GS, Sriram R, da Silva AJ. Multiplex real-time PCR assay for simultaneous detection of Acanthamoeba spp., Balamuthia mandrillaris, and Naegleria fowleri.
176.Robinson BS, Monis PT, Dobson PJ. Rapid, sensitive, and discriminating identification of Naegleria spp. by real-time PCR and melting-curve analysis.
177.Marciano-Cabral F, MacLean R, Mensah A, LaPat-Polasko L. Identification of Naegleria fowleri in domestic water sources by nested PCR.
178.Visvesvara GS. Parasite Culture: Acanthamoeba and Naegleria spp. In: Garcia LS, editor. Clinical Microbiology Procedures Handbook. 3rd ed.
179.Yoder JS, Eddy BA, Visvesvara GS, Capewell L, Beach MJ. The epidemiology of primary amoebic meningoencephalitis in the USA, 1962-2008.
180.Seidel JS, Harmatz P, Visvesvara GS, Cohen A, Edwards J, Turner J. Successful treatment of primary amebic meningoencephalitis.
181.Visvesvara GS, Moura H, Schuster FL. Pathogenic and opportunistic free-living amoebae: Acanthamoeba spp., Balamuthia mandrillaris, Naegleria fowleri, and Sappinia diploidea.
182.Vargas-Zepeda J, Gomez-Alcala AV, Vasquez-Morales JA, Licea-Amaya L, De Jonckheere JF, Lores-Villa F. Successful treatment of Naegleria PAM using IV amphotericin B, fluconazole, and rifampin.
183.John DT, John RA. Cytopathogenicity of Naegleria fowleri in mammalian cell cultures.
184.Visvesvara GS. Free-living amebae as opportunistic agents of human disease.
185.Visvesvara GS, Moura H, Schuster FL. Pathogenic and opportunistic free-living amoebae: Acanthamoeba spp., Balamuthia mandrillaris, Naegleria fowleri, and Sappinia diploidea.
186.Visvesvara GS. Pathogenic and Opportunistic Amebae. Manual of Clinical Microbiology, 9th ed. Murray PR, Baron EJ, Jorgensen JH, Landry ML, Pfaller MA, editors.
187.Marciano-Cabral F, Cabral G. Acanthamoeba spp. as agents of disease in humans.
188.Hlavsa MC, Roberts VA,
189.Yoder JS, Eddy BA, Visvesvara GS, Capewell L, Beach MJ. The epidemiology of primary amoebic meningoencephalitis in the USA, 1962-2008.
190.Yoder J, Hlavsa M, Craun GF, Hill V, Roberts V, Yu P, Hicks LA, Alexander NT, Calderon RL, Roy SL, Beach MJ. (2008) Surveillance for waterborne disease and outbreaks associated with recreational water use and other aquatic facility-associated health events — United States, 2005–2006.
191.Herwaldt BL, Craun GF, Stokes SL, Juranek DD. Waterborne-disease outbreaks, 1989-1990.
192.Yoder JS, Straif-Bourgeois S, Roy SL, Moore TA, Visvesvara GS, Ratard RC, Hill V, Wilson JD, Linscott AJ, Crager R, Kozak NA, Sriram R, Narayanan J, Mull B, Kahler AM, Schneeberger C, da Silva AJ, Beach MJ. Deaths from Naegleria fowleri associated with sinus irrigation with tap water: a review of the changing epidemiology of primary amebic meningoencephalitis.
193.Kemble SK, Lynfield R, DeVries AS, Drehner DM, Pomputius WF 3rd, Beach MJ, Visvesvara GS, da Silva AJ, Hill VR, Yoder JS, Xiao L, Smith KE, Danila R. Fatal Naegleria fowleri infection acquired in Minnesota: possible expanded range of a deadly thermophilic organism.
194.Tuppeny M. Primary amoebic meningoencephalitis with subsequent organ procurement: a case study.
195.Yoder JS, Eddy BA, Visvesvara GS, Capewell L, Beach MJ. The epidemiology of primary amoebic meningoencephalitis in the USA, 1962-2008.
196.Puzon GJ, Lancaster JA, Wylie JT, Plumb IJ. Rapid detection of Naegleria fowleri in water distribution pipeline biofilms and drinking water samples.
197.US Census Bureau. Statistical Abstract of the United States: 2012. Arts, Recreation, and Travel: Participation in Selected Sports Activities 2009.
198.Bennett WM, Nespral JF, Rosson MW, McEvoy KM. Use of organs for transplantation from a donor with primary meningoencephalitis due to Naegleria fowleri.
199.Blair B, Sarkar P, Bright KR, Marciano-Cabral F, Gerba CP. Naegleria fowleri in well water.
200.Visvesvara GS, De Jonckheere JF, Sriram R, Daft B. Isolation and molecular typing of Naegleria fowleri from the brain of a cow that died of primary amebic meningoencephalitis.
201.Maclean RC, et al. The identification of Naegleria fowleri from water and soil samples by nested PCR.
202.Ettinger MR, Webb SR, Harris SA, McIninch SP, C Garman G, Brown BL. Distribution of free-living amoebae in James River, Virginia, USA.
203.Sheehan KB, Fagg JA, Ferris MJ, Henson JM. PCR detection and analysis of the free-living amoeba Naegleria in hot springs in Yellowstone and Grand Teton National Parks.
204.Cabanes PA, Wallet F, Pringuez E, Pernin P. Assessing the risk of primary amoebic meningoencephalitis from swimming in the presence of environmental Naegleria fowleri.
205.John DT, Howard MJ. Seasonal distribution of pathogenic free-living amebae in Oklahoma waters.
206.Dorsch MM, Cameron AS, Robinson BS. The epidemiology and control of primary amoebic meningoencephalitis with particular reference to South Australia.
207.John DT, Nussbaum SL. Naegleria fowleri infection acquired by mice through swimming in amebae-contaminated water.
208.Sykora JK, Keleti G, Martinez AJ. Occurrence and pathogenicity of Naegleria fowleri in artificially heated waters.
209.Duma RJ. Study of pathogenic free-living amebas in fresh-water lakes in
210.Wellings FM, et al. Isolation and identification of pathogenic Naegleria from Florida lakes.
211.Stevens AR, Tyndall RL, Coutant CC, Willaert E. Isolation of the etiological agent of primary amoebic meningoencephalitis from artificially heated waters.
212.
213.Anderson K, Jamieson A. Primary amoebic meningoencephalitis. Lancet. 1972;1:902–3.
214.Gustavo dos Santos Neto. Fatal primary amebic meningoencephalitis. A retrospective study in
215.Visvesvara GS. Amebic meningoencephalitides and keratitis: challenges in diagnosis and treatment.
216.Visvesvara GS. Parasite Culture: Acanthamoeba and Naegleria spp. In: Garcia LS, editor. Clinical Microbiology Procedures Handbook. 3rd ed.
217.da Rocha-Azevedo B, Tanowitz HB, Marciano-Cabral F. Diagnosis of infections caused by pathogenic free-living amoebae.
218.Qvarnstrom Y, Visvesvara GS, Sriram R, da Silva AJ. Multiplex real-time PCR assay for simultaneous detection of Acanthamoeba spp., Balamuthia mandrillaris, and Naegleria fowleri.
219.Robinson BS, Monis PT, Dobson PJ. Rapid, sensitive, and discriminating identification of Naegleria spp. by real-time PCR and melting-curve analysis.
220.Marciano-Cabral F, MacLean R, Mensah A, LaPat-Polasko L. Identification of Naegleria fowleri in domestic water sources by nested PCR.
221.Marciano-Cabral F, MacLean R, Mensah A, LaPat-Polasko L. Identification of Naegleria fowleri in domestic water sources by nested PCR.
222.Martínez DY, Seas C, Bravo F, Legua P, Ramos C, Cabello AM, Gotuzzo E. Successful treatment of Balamuthia mandrillaris amoebic infection with extensive neurological and cutaneous involvement.
223.Walochnik J, Obwaller A, Gruber F, Mildner M, Tschachler E, Suchomel M, Duchene M, Auer H. Anti-Acanthamoeba efficacy and toxicity of miltefosine in an organotypic skin equivalent.
224.Kim JH, Jung SY, Lee YJ, Song KJ, Kwon D, Kim K, Park S, Im KI, Shin HJ. Effect of therapeutic chemical agents in vitro and on experimental meningoencephalitis due to Naegleria fowleri.
225.Aichelburg AC, Walochnik J, Assadian O, Prosch H, Steuer A, Perneczky G, Visvesvara GS, Aspöck H, Vetter N. Successful treatment of disseminated Acanthamoeba sp. infection with miltefosine.
226.Soltow SM, Brenner GM. Synergistic activities of azithromycin and amphotericin B against Naegleria fowleri in vitro and in a mouse model of primary amebic meningoencephalitis.
227.
228.Vargas-Zepeda J, Gomez-Alcala AV, Vasquez-Morales JA, Licea-Amaya L, De Jonckheere JF, Lores-Villa F. Successful treatment of Naegleria PAM using IV amphotericin B, fluconazole, and rifampin.
229.
230.
231.Deetz TR, Sawyer MH, Billman G,
232.Goswick SM, Brenner GM. Activities of azithromycin and amphotericin B against Naegleria fowleri in vitro and in a mouse model of primary amebic meningoencephalitis.
233.Goswick SM, Brenner GM. Activities of therapeutic agents against Naegleria fowleri in vitro and in a mouse model of primary amebic meningoencephalitis.
234.Jain R, Prabhaker S, Modi M, Bhatia R, Sehgal R. Naegleria meningitis: A rare survival.
235.Kaminsky R. Miltefosine Zentaris.
236.Seidel J, Harmatz P, Visvesvara GS, Cohen A, Edwards J, Turner J. Successful treatment of primary amebic meningoencephalitis.
237.Ferrante A. Comparative sensitivity of Naegleria fowleri to amphotericin B and amphotericin B methyl ester.
238.Lee KK, Karr SL Jr, Wong MM, Hoeprich PD. In vitro susceptibilities of Naegleria fowleri strain HB-1 to selected antimicrobial agents, singly and in combination.
239.Kramer MH, Lerner CJ, Visvesvara GS. Kidney and liver transplants from a donor infected with Naegleria fowleri.
240.Sarkar P, Gerba C. Inactivation of Naegleria fowleri by chlorine and ultraviolet light. J AWWA. 2012;104:51-2.
241.Visvesvara G, Yoder J, Beach MJ. (2012) Primary amebic meningoencephalitis Chapter 73, pgs 442-7. In: Netter's Infectious Diseases, Eds. Yong EC, Stevens DL. Elsevier Saunders. Philadelphia, PA.
242.Visvesvara GS, De Jonckheere JF, Sriram R, Daft B. Isolation and molecular typing of Naegleria fowleri from the brain of a cow that died of primary amebic meningoencephalitis.
243.Tiewchaloren S, Junnu V. Factors affecting the viability of pathogenic Naegleria species isolated from Thai patients.
244.Lozano-Alarcón F, Bradley GA, Houser BS, Visvesvara GS. Primary amebic meningoencephalitis due to Naegleria fowleri in a South American tapir.
245.John DT, John RA. Cytopathogenicity of Naegleria fowleri in mammalian cell cultures.
246.Robinson BS, Christy PE. Disinfection of water for control of amoebae. Water. 1984;September:21-4.
247.Rice EW, Hoff JC, Schaefer FW 3rd. Inactivation of Giardia cysts by chlorine.
248.Jarroll EL,
249.Cursons RT, Brown TJ, Keys EA. Effect of disinfectants on pathogenic free-living amoebae: in axenic conditions.
250.Chang SL. Resistance of pathogenic Naegleria to some common physical and chemical agents.
251.Stevens AR, Tyndall RL, Coutant CC, Willaert E. Isolation of the etiological agent of primary amoebic meningoencephalitis from artificially heated waters.
252.De Jonckheere J, van de Voorde H. Differences in destruction of cysts of pathogenic and nonpathogenic Naegleria and Acanthamoeba by chlorine.
253.Griffin JL. Temperature tolerance of pathogenic and nonpathogenic free-living amoebas.
254.Gustavo dos Santos Neto. Fatal primary amebic meningoencephalitis. A retrospective study in Richmond, Virginia. Am J Clin Pathol. 1970;54:737-42.
255.Butt CG. Primary amebic meningoencephalitis.
256.Fowler M, Carter RF. Acute pyogenic meningitis probably due to Acanthamoeba sp.: a preliminary report.
257.Marciano-Cabral F, Cabral G. The immune response to Naegleria fowleri amebae and pathogenesis of infection.
258.Visvesvara GS, De Jonckheere JF, Marciano-Cabral F, Schuster FL. Morphologic and molecular identification of Naegleria dunnebackei n. sp. isolated from a water sample.
259.Yoder JS, Straif-Bourgeois S, Roy SL, Moore TA, Visvesvara GS, Ratard RC, Hill V, Wilson JD, Linscott AJ, Crager R, Kozak NA, Sriram R, Narayanan J, Mull B, Kahler AM, Schneeberger C, da Silva AJ, Beach MJ. Deaths from Naegleria fowleri associated with sinus irrigation with tap water: a review of the changing epidemiology of primary amebic meningoencephalitis.
260.Shakoor S, Beg MA, Mahmood SF, Bandea R, Sriram R, Noman F, et al. Primary amebic meningoencephalitis caused by Naegleria fowleri, Karachi, Pakistan.
261.CDC. Primary amebic meningoencephalitis—Arizona, Florida and Texas, 2007.MMWR Morb Mortal Wkly Rep. 2008;57(21):573-7.
262.CDC. Primary amebic meningoencephalitis—Georgia, 2002.MMWR Morb Mortal Wkly Rep. 2003;52(40):962-4.
263.CDC. Primary amebic meningoencephalitis—North Carolina, 1991.MMWR Morb Mortal Wkly Rep. 1992;41(25):437-40.
264.CDC. Primary amebic meningoencephalitis—California, Florida, New York.MMWR Morb Mortal Wkly Rep. 1978;27:343-4.
265.Yoder JS, Eddy BA, Visvesvara GS, Capewell L, Beach MJ. The epidemiology of primary amoebic meningoencephalitis in the USA, 1962-2008.
266.Seidel JS, Harmatz P, Visvesvara GS, Cohen A, Edwards J, Turner J. Successful treatment of primary amebic meningoencephalitis.
267.Visvesvara GS, Moura H, Schuster FL. Pathogenic and opportunistic free-living amoebae: Acanthamoeba spp., Balamuthia mandrillaris, Naegleria fowleri, and Sappinia diploidea.
268.Vargas-Zepeda J, Gomez-Alcala AV, Vasquez-Morales JA, Licea-Amaya L, De Jonckheere JF, Lores-Villa F. Successful treatment of Naegleria PAM using IV amphotericin B, fluconazole, and rifampin.
269.John DT, John RA. Cytopathogenicity of Naegleria fowleri in mammalian cell cultures.
270.Kaminsky R. Miltefosine Zentaris
271.Schuster FL, Guglielmo BJ, Visvesvara GS. In-vitro activity of miltefosine and voriconazole on clinical isolates of free-living amebas: Balamuthia mandrillaris, Acanthamoeba spp., and Naegleria fowleri.
272.Kim JH, Jung SY, Lee YJ, Song KJ, Kwon D, Kim K, Park S, Im KI, Shin HJ. Effect of therapeutic chemical agents in vitro and on experimental meningoencephalitis due to Naegleria fowleri.
273.Martínez DY, Seas C, Bravo F, Legua P, Ramos C, Cabello AM, Gotuzzo E. Successful treatment of Balamuthia mandrillaris amoebic infection with extensive neurological and cutaneous involvement.
274.Aichelburg AC, Walochnik J, Assadian O, Prosch H, Steuer A, Perneczky G, Visvesvara GS, Aspöck H, Vetter N. Successful treatment of disseminated Acanthamoeba sp. infection with miltefosine.
275.Visvesvara GS. Free-living amebae as opportunistic agents of human disease.
276.Visvesvara GS, Moura H, Schuster FL. Pathogenic and opportunistic free-living amoebae: Acanthamoeba spp., Balamuthia mandrillaris, Naegleria fowleri, and Sappinia diploidea.
277.Marciano-Cabral F, Cabral G. The immune response to Naegleria fowleri amebae and pathogenesis of infection.
278.Maclean RC, et al. The identification of Naegleria fowleri from water and soil samples by nested PCR.
279.Wellings FM, et al. Isolation and identification of pathogenic Naegleria from Florida lakes.
280.John DT, Howard MJ. Seasonal distribution of pathogenic free-living amebae in Oklahoma waters.
281.Duma RJ. Study of pathogenic free-living amebas in fresh-water lakes in Virginia. EPA Publication. 1980;EPA-PB-126369, Summary, 1981 is EPA-600/S1-80-037.
282.Ettinger MR, Webb SR, Harris SA, McIninch SP, C Garman G, Brown BL. Distribution of free-living amoebae in James River, Virginia, USA.
283.Kemble SK, Lynfield R, DeVries AS, Drehner DM, Pomputius WF 3rd, Beach MJ, Visvesvara GS, da Silva AJ, Hill VR, Yoder JS, Xiao L, Smith KE, Danila R. Fatal Naegleria fowleri infection acquired in Minnesota: possible expanded range of a deadly thermophilic organism.
284.US Census Bureau. Statistical Abstract of the United States: 2012. Arts, Recreation, and Travel: Participation in Selected Sports Activities 2009.
285.Yoder JS, Eddy BA, Visvesvara GS, Capewell L, Beach MJ. The epidemiology of primary amoebic meningoencephalitis in the USA, 1962-2008.
286.Cabanes PA, Wallet F, Pringuez E, Pernin P. Assessing the risk of primary amoebic meningoencephalitis from swimming in the presence of environmental Naegleria fowleri.
287.Shakoor S, Beg MA, Mahmood SF, Bandea R, Sriram R, Noman F, Ali F, Visvesvara GS, Zafar A. Primary amebic meningoencephalitis caused by Naegleria fowleri, Karachi, Pakistan.
288.Yoder JS, Straif-Bourgeois S, Roy SL, Moore TA, Visvesvara GS, Ratard RC, Hill V, Wilson JD, Linscott AJ, Crager R, Kozak NA, Sriram R, Narayanan J, Mull B, Kahler AM, Schneeberger C, da Silva AJ, Beach MJ. Deaths from Naegleria fowleri associated with sinus irrigation with tap water: a review of the changing epidemiology of primary amebic meningoencephalitis.
289.Herwaldt BL, Craun GF, Stokes SL, Juranek DD. Waterborne-disease outbreaks, 1989-1990. [PDF - 22 pages] MMWR Surveill Summ. 1991;40:1-21.
290.Yoder JS, Straif-Bourgeois S, Roy SL, Moore TA, Visvesvara GS, Ratard RC, Hill V, Wilson JD, Linscott AJ, Crager R, Kozak NA, Sriram R, Narayanan J, Mull B, Kahler AM, Schneeberger C, da Silva AJ, Beach MJ. Deaths from Naegleria fowleri associated with sinus irrigation with tap water: a review of the changing epidemiology of primary amebic meningoencephalitis.http://www.cdc.gov/Other/disclaimer.html
291.Lopez C, Budge P, Chen J, Bilyeu S, Mirza A, Custodio H, Irazuzta J, Visvesvara G, Sullivan KJ. Primary amebic meningoencephalitis: a case report and literature review. Pediatr Emerg Care. 2012 Mar;28(3):272-6.
292.Kemble SK, Lynfield R, DeVries AS, Drehner DM, Pomputius WF 3rd, Beach MJ, Visvesvara GS, da Silva AJ, Hill VR, Yoder JS, Xiao L, Smith KE, Danila R. Fatal Naegleria fowleri infection acquired in Minnesota: possible expanded range of a deadly thermophilic organism.http://www.cdc.gov/Other/disclaimer.htmlhttp://www.cdc.gov/Other/disclaimer.html Clin Infect Dis. 2012;54:805-9.
293.CDC. Primary amebic meningoencephalitis--Arizona, Florida, and Texas, 2007.MMWR Morb Mortal Wkly Rep. 2008;57:573-7.
294.Guarner J, Bartlett J, Shieh WJ, Paddock CD, Visvesvara GS, Zaki SR. Histopathologic spectrum and immunohistochemical diagnosis of amebic meningoencephalitis. Mod Pathol. 2007 Dec;20(12):1230-7.
295.Shakoor S, Beg MA, Mahmood SF, Bandea R, Sriram R, Noman F, et al. Primary amebic meningoencephalitis caused by Naegleria fowleri, Karachi, Pakistan. [PDF - 4 pages]http://www.cdc.gov/Other/disclaimer.htmlhttp://www.cdc.gov/Other/disclaimer.html Emerg Infect Dis. 2011:17;258-61.
296.Cogo PE, Scagli M, Gatti S, Rossetti F, Alaggio R, Laverda AM, Zhou L, Xiao L, Visvesvara GS. Fatal Naegleria fowleri meningoencephalitis, Italy. Emerg Infect Dis. 2004 Oct;10(10):1835-7.
297.CDC. Primary amebic meningoencephalitis, Georgia, 2002.MMWR Morb Mortal Wkly Rep. 2003;52(40):962-4.
298.CDC. Primary amebic meningoencephalitis, North Carolina, 1991.MMWR Morb Mortal Wkly Rep. 1992;41(25):437-40.
299.CDC. Primary amebic meningoencephalitis, California, Florida, New York.MMWR Morb Mortal Wkly Rep. 1978;27:343-4.
300.Vargas-Zepeda J, Gomez-Alcala AV, Vasquez-Morales JA, Licea-Amaya L, De Jonckheere JF, Lores-Villa F. Successful treatment of Naegleria PAM using IV amphotericin B, fluconazole, and rifampin.http://www.cdc.gov/Other/disclaimer.htmlhttp://www.cdc.gov/Other/disclaimer.html Arch Med Research 2005;36:83-6.
301.Schuster FL, Visvesvara GS. Free-living opportunistic and non-opportunistic pathogens of humans and animals.http://www.cdc.gov/Other/disclaimer.htmlhttp://www.cdc.gov/Other/disclaimer.html Int J Parasitiol 2004;34:1001-27.
302.Schuster FL, Visvesvara GS. Opportunistic amebae: challenges in prophylaxis and treatment.http://www.cdc.gov/Other/disclaimer.htmlhttp://www.cdc.gov/Other/disclaimer.html Drug Resistance Updates 2004;7:41-51.
303.Seidel J, Harmatz P, Visvesvara GS, Cohen A, Edwards J, Turner J. Successful treatment of primary amebic meningoencephalitis.http://www.cdc.gov/Other/disclaimer.htmlhttp://www.cdc.gov/Other/disclaimer.html New Engl J Med 1982;306:346-8.
304.Visvesvara GS, De Jonckheere JF, Sriram R, Daft B. Isolation and molecular typing of Naegleria fowleri from the brain of a cow that died of primary amebic meningoencephalitis.http://www.cdc.gov/Other/disclaimer.htmlhttp://www.cdc.gov/Other/disclaimer.html J Clin Microbiol. 2005;43:4203-4.
305.Lozano-Alarcón F, Bradley GA, Houser BS, Visvesvara GS. Primary amebic meningoencephalitis due to Naegleria fowleri in a South American tapir.http://www.cdc.gov/Other/disclaimer.htmlhttp://www.cdc.gov/Other/disclaimer.html Vet Pathol. 1997 May;34(3):239-43.
306.Visvesvara GS, De Jonckheere JF, Marciano-Cabral F, Schuster FL. Morphologic and molecular identification of Naegleria dunnebackei n. sp. isolated from a water sample.http://www.cdc.gov/Other/disclaimer.htmlhttp://www.cdc.gov/Other/disclaimer.html J Eukaryot Microbiol. 2005;52:523-31.
307.Yoder JS, Eddy BA, Visvesvara GS, Capewell L, Beach MJ. The epidemiology of primary amoebic meningoencephalitis in the USA, 1962-2008.http://www.cdc.gov/Other/disclaimer.htmlhttp://www.cdc.gov/Other/disclaimer.html Epidemiol Infect. 2010;138:968-75.
308.Council for State and Territorial Epidemiologists (CSTE). Case Definitions for Non-notifiable Infections Caused by Free-living Amebae (Naegleria fowleri, Balamuthia mandrillaris, and Acanthamoeba spp.) [PDF - 10 pages].http://www.cdc.gov/Other/disclaimer.htmlhttp://www.cdc.gov/Other/disclaimer.html Infectious Disease Committee. 2012.
309.Visvesvara G, Yoder J, Beach MJ. (2012) Primary amebic meningoencephalitis Chapter 73, pgs 442-7. In: Netter's Infectious Diseases, Eds. Yong EC, Stevens DL. Elsevier Saunders. Philadelphia, PA.
310.Visvesvara G. Pathogenic and opportunistic free-living amebae. In: Versalovic J, Carroll K, Funke G, Jorgensen J, Landry M, Warnock D, editors. Manual of Clinical Microbiology. 10 ed. Washington, DC: ASM Press; 2011. p. 2139-48.
311.Visvesvara G, Roy S, Maguire J. Pathogenic and opportunistic free-living amebae: Acanthamoeba spp., Balamuthia mandrillaris, Naegleria fowleri, and Sappinia pedata. In: Guerrant R, Walker D, Weller P, editors. Tropical Infectious Diseases: Principles, Pathogens and Practice: Expert Consult. 3 ed: WB Saunders Company; 2011. p. 1-9, e1-e2.
312.Visvesvara GS. Free-living amebae as opportunistic agents of human disease. [PDF - 13 pages]http://www.cdc.gov/Other/disclaimer.html
313.Visvesvara GS. Amebic meningoencephalitides and keratitis: challenges in diagnosis and treatment.http://www.cdc.gov/Other/disclaimer.html
314.http://www.cdc.gov/Other/disclaimer.html Curr Opin Infect Dis. 2010 Dec;23(6):590-4.
315.Visvesvara GS. Parasite Culture: Acanthamoeba and Naegleria spp. In: Garcia LS, editor. Clinical Microbiology Procedures Handbook. 3rd ed. Washington, DC: ASM Press;2010.
316.Visvesvara GS, Moura H, Schuster FL. Pathogenic and opportunistic free-living amoebae: Acanthamoeba spp., Balamuthia mandrillaris, Naegleria fowleri, and Sappinia diploidea.http://www.cdc.gov/Other/disclaimer.html.
317.Visvesvara GS. Pathogenic and Opportunistic Amebae. Manual of Clinical Microbiology, 9th ed. Murray PR, Baron EJ, Jorgensen JH, Landry ML, Pfaller MA, editors. Washington DC: ASM Press. 2007. p. 2082-91.
318.Schuster FL, Visvesvara GS. Opportunistic amebae: challenges in prophylaxis and treatment.http://www.cdc.gov/Other/disclaimer.html
319.http://www.cdc.gov/Other/disclaimer.html Drug Resistance Updates 2004;7:41-51.
320.Schuster FL, Guglielmo BJ, Visvesvara GS. In-vitro activity of miltefosine and voriconazole on clinical isolates of free-living amebas: Balamuthia mandrillaris, Acanthamoeba spp., and Naegleria fowleri.http://www.cdc.gov/Other/disclaimer.
321.Visvesvara GS, Peralta MJ, Brandt FH, Wilson M, Aloisio C, Franko E. Production of monoclonal antibodies to Naegleria fowleri, agent of primary amebic meningoencephalitis. J Clin Microbiol. 1987;25:1629-34.
322.Visvesvara GS, Healy GR. Comparative antigenic analysis of pathogenic and free-living Naegleria species by the gel diffusion and immunoelectrophoresis techniques. Infect Immunity. 1975;11:95-108.
323.Qvarnstrom Y, Visvesvara GS, Sriram R, da Silva AJ. Multiplex real-time PCR assay for simultaneous detection of Acanthamoeba spp., Balamuthia mandrillaris, and Naegleria fowleri.http://www.cdc.gov/Other/disclaimer.html
324.Zhou L, Sriram R, Visvesvara GS, Xiao L. Genetic variations in the internal transcribed spacer and mitochondrial small subunit rRNA gene of Naegleria spp. J Eukaryot Microbiol. 2003;50 Suppl:522-6.
| Ngày 21/02/2014 |
| PGS.TS. Triệu Nguyên Trung và Ths.Bs. Huỳnh Hồng Quang |
|
||||
|
|
||||
|
|
|
|
|
| |
|
Trang tin điện tử Viện Sốt rét - Ký Sinh trùng - Côn trùng Quy Nhơn Giấy phép thiết lập số 53/GP - BC do Bộ văn hóa thông tin cấp ngày 24/4/2005Địa chỉ: Khu vực 8-Phường Nhơn Phú-Thành phố Quy Nhơn-Tỉnh Bình Định.Tel: (84) 0256.3846.892 - Fax: (84) 0256.3647464 Email: impequynhon.org.vn@gmail.com Trưởng Ban biên tập: TTND.PGS.TS. Hồ Văn Hoàng-Viện trưởng Phó Trưởng ban biên tập: TS.BS.Huỳnh Hồng Quang-Phó Viện trưởng |
| • Thiết kế bởi công ty cổ phần phần mềm: Quảng Ích |